G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,998
- Solutions
- 3
- Reaction score
- 3,370
- Points
- 113
- Deals
- 1
Introducere
Cum să transformați gramele în mililitri și invers?
Ce înseamnă moli?
Ce este masa molară?
Cum se transformă molii în grame și viceversa?
Unalt exemplu: trebuie să adăugați 10 moli de borohidridă de sodiu (NaBH4) cu masa moleculară de 37,83 g/moli la reacție și trebuie să numărați în grame:
Cum se numără reactivii?
Cum se numără randamentul unei reacții?
Apoi, numărați câți moli dintr-un reactiv lipsă (P2P în acest exemplu) iau parte la reacție.
Primesc o mulțime de întrebări similare despre randamentul reacțiilor, cantitatea de reactivi, cum să transform o dimensiune în alta și observ că oamenii nu știu să numere corect aceste numere simple, dar foarte importante. Am decis să descriu metodele corecte în acest subiect. Dacă nu înțelegeți ceva, nu ezitați să întrebați și să discutați întrebările dvs. în secțiunea de comentarii.
Cum să transformați gramele în mililitri și invers?
Gramul (simbolul unității SI g) este o unitate de masă în SistemulInternațional de Unități(SI) egală cu o miime dintr-un kilogram (1/1000). Gramul este greutatea absolută a unui volum de apă pură egal cu cubul a suta parte dintr-un metru [1 cm3] și la temperatura de topire a gheții, temperatura definitorie (~0 °C) a fost modificată ulterior la 4 °C, temperatura de densitate maximă a apei.
Factori de conversie
Factori de conversie
- 1 gram (g) = 15,4323583529 boabe (gr).
- 1 bob (gr) = 0,06479891 grame.
- 1 uncie avoirdupois (oz) = 28,349523125 grame.
- 1 uncie troy (ozt) = 31,1034768 grame.
- 100 grame (g) = 3,527396195 uncii (oz).
- 1 carat (ct) = 0,2 grame.
- 1 gamma (γ) = 10-6 grame.
- 1 undecimogramă = 1 "a unsprezecea gramă" = 10-11 grame în sistemul istoric cvadrant-eleventh-gram-second (sistemul QES), cunoscut și ca sistemul hebdometru-undecimogramă-secundă (sistemul HUS).
- 500 de grame (g) = 1 jin în unitățile de măsură chinezești.
Litrul (ortografie internațională) sau litrul (ortografie engleză americană), simboluri SI L și l. Litrul este o unitate metrică de volum. Este egal cu 1 decimetru cub (dm3), 1000 centimetri cubi (cm3) sau 0,001 metri cubi (m3). Un decimetru cub (sau litru) ocupă un volum de 10 cm × 10 cm × 10 cm (a se vedea figura) și este astfel egal cu o miime dintr-un metru cub. Mililitrul, simbol SI ml sau mL este centimetru cub. Un centimetru cub (sau ml) ocupă un volum de 1 cm × 1 cm × 1 cm și este astfel egal cu o miime dintr-un litru (1/1000).
Factori de conversie

Factori de conversie
- 1 litru imperial = 1,1365225 L.
- 1 litru american = 0,946352946 L.
- 1 pint imperial = 0,56826125 L.
- 1 halbă americană = 0,473176473 L.
- 1 galon imperial = 4,54609 L.
- 1 galon american = 3,785411784 L.
- 1 picior cub = 28,316846592 L.
- 1 inch cub = 0,016387064 L.
- 1 uncie fluidă imperială = 28,4130625 mL.
- 1 uncie fluidă americană = 29,5735295625 mL.
Gramele pot fi ușor transformate în mililitri conform acestei formule.
V = m / ρ.
unde m - masa substanței, g; ρ - densitatea substanței, g/ml; V - volumul substanței.
Conform acestei formule, puteți transforma orice substanță în volum și viceversa. De exemplu, aveți 20 g de mercur (Hg) și doriți să îi calculați masa. ρ (densitatea) mercurului este de 13,5 g/ml, prin urmare
Conform acestei formule, puteți transforma orice substanță în volum și viceversa. De exemplu, aveți 20 g de mercur (Hg) și doriți să îi calculați masa. ρ (densitatea) mercurului este de 13,5 g/ml, prin urmare
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml este volumul a 20 g de mercur.
Ce înseamnă moli?
Molul, simbol mol, n, este unitatea de măsură a cantității de substanță în Sistemul Internațional de Unități (SI). Cantitatea de cantitate de substanță este o măsură a numărului de entități elementare ale unei substanțe date care se află într-un obiect sau eșantion (în orice substanță). Molul este definit ca conținând exact 6,02214085774 × 10²³ particule (atomi, molecule, ioni, electroni sau orice alte obiecte). De exemplu, 10 moli de apă (un compus chimic H2O) și 10 moli de mercur (un element chimic Hg) conțin cantități egale de substanță, iar mercurul conține exact un atom pentru fiecare moleculă de apă, deși cele două au volume și mase diferite. Oricum, este destul de mult, nu-i așa? Acesta este motivul pentru care este mai convenabil să știți cum să convertiți gramele în moli în loc de grame în numărul de atomi.
Ce este masa molară?
Masa molară este o caracteristică a unei substanțe, raportul dintre masa unei substanțe și cantitatea sa. Numeric egală cu masa a 1 mol dintr-o substanță, adică masa unei substanțe conține un număr de particule egal cu numărul lui Avogadro. Masa molară, exprimată în g/mol, coincide numeric cu masa moleculară, exprimată în r.a.m., și cu masa atomică relativă. Cu toate acestea, există o diferență între masa molară și masa moleculară, acestea sunt egale doar numeric și diferă ca dimensiune.
De exemplu, masa molară a oxigenului ca element M(O) = 16 g/mol, dar ca substanță simplă formată din molecule O2 = 32 g/mol.
Masele molare ale moleculelor complexe pot fi determinate prin însumarea maselor molare ale elementelor care le compun. De exemplu, masa moleculară a apei H2O este
De exemplu, masa molară a oxigenului ca element M(O) = 16 g/mol, dar ca substanță simplă formată din molecule O2 = 32 g/mol.
Masele molare ale moleculelor complexe pot fi determinate prin însumarea maselor molare ale elementelor care le compun. De exemplu, masa moleculară a apei H2O este
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Cum se transformă molii în grame și viceversa?
Pentru a evalua corect numărul de moli, n, ai unei substanțe cu o masă specifică, m, (în grame), trebuie să urmați formula de transformare a gramilor în moli.
n = m / M.
unde: M - masa molară a acestui material. Unitatea este de obicei g/mol; m - masa substanței, g; n - molii substanței, mol.
Deexemplu, aveți 100 g de P2NP, care are 163,17 g/mol masă moleculară. Trebuie să calculați câți moli are. Conform formulei de mai sus.
Deexemplu, aveți 100 g de P2NP, care are 163,17 g/mol masă moleculară. Trebuie să calculați câți moli are. Conform formulei de mai sus.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 moli.
Unalt exemplu: trebuie să adăugați 10 moli de borohidridă de sodiu (NaBH4) cu masa moleculară de 37,83 g/moli la reacție și trebuie să numărați în grame:
m(NaBH4) = 10 moli x 37,83 g/mol = 378,3 g.
Cum se numără reactivii?
Ați deschis manualul de sinteză și v-ați dat seama că aveți nevoie de o sinteză la scară mult mai mică sau mai mare. Sunteți derutat de numere și nu știți cum să le numărați la scara dumneavoastră? Există o explicație.
În cazul în care doriți să măriți o scară de sinteză și sunteți sigur că este posibil să o faceți conform dependenței liniare, trebuie doar să înmulțiți toate cantitățile de reactivi cu același indice. Veți obține cantitățile de reactivi pentru scara dvs. de sinteză și nu trebuie să întrebați niciun expert despre acest lucru!
Exemplu: doriți să realizați sinteza amfetaminei prin NaBH4/CuCl2 și trebuie să luați 1000 g de P2NP pentru această sinteză în conformitate cu manualul de pe forumul BB. Doriți să efectuați o sarcină de sinteză de 150 g P2NP. Algoritmul dvs. este.
În cazul în care doriți să măriți o scară de sinteză și sunteți sigur că este posibil să o faceți conform dependenței liniare, trebuie doar să înmulțiți toate cantitățile de reactivi cu același indice. Veți obține cantitățile de reactivi pentru scara dvs. de sinteză și nu trebuie să întrebați niciun expert despre acest lucru!
Exemplu: doriți să realizați sinteza amfetaminei prin NaBH4/CuCl2 și trebuie să luați 1000 g de P2NP pentru această sinteză în conformitate cu manualul de pe forumul BB. Doriți să efectuați o sarcină de sinteză de 150 g P2NP. Algoritmul dvs. este.
1. Împărțiți 1000 g din cantitatea de precursor principal P2NP descrisă în manual la 150 g și veți obține indicele necesar 6,67.
2. Împărțiți toate cantitățile de reactivi la 6,67 și veți ajunge la obiectivul dvs.
În cazul în care trebuie să măriți această sarcină de sinteză de la 1000 g P2NP la 2500 g, urmați următoarele instrucțiuni.
1. Împărțiți 2500 g P2NP la 1000 g și veți obține indicele 2,5.
2. Înmulțiți toți reactivii cu 2,5 și veți ajunge la obiectivul dvs.
Cum se numără randamentul unei reacții?
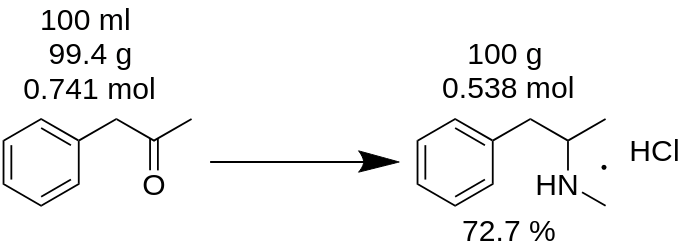
Ați efectuat sinteza clorhidratului de metamfetamină din 100 ml P2P și ați obținut 100 g de produs. Credeți că ați obținut un randament de 100%? Este greșit!
Exemplu.
Exemplu.
Înprimul rând, trebuie să numărați masa de P2P, care a fost utilizată pentru această sinteză.
m(P2P) = 100 ml / 1,006 = 99,4 g
Apoi, numărați câți moli dintr-un reactiv lipsă (P2P în acest exemplu) iau parte la reacție.
n(P2P) = 99,4 g / 134,178 g/mole = 0,741 moli.
Un reactiv lipsă este reactivul care participă la reacție și care are cea mai mică cantitate molară. De exemplu, în reacția de aminare reductivă a P2P la metamfetamină, trebuie să luați 1 mol de P2P și ~3,5 moli de metilamină. P2P este reactivul lipsă în această reacție.
Conform bilanțului reacției, 1 mol de P2P dă 1 mol de clorhidrat de metamfetamină. Prinurmare, 0,741 moli de P2P dau 0,741 moli de clorhidrat de metamfetamină (MH), care este
Conform bilanțului reacției, 1 mol de P2P dă 1 mol de clorhidrat de metamfetamină. Prinurmare, 0,741 moli de P2P dau 0,741 moli de clorhidrat de metamfetamină (MH), care este
m(MH) = 0,741 moli x 185,69 g/mole = 137,56 g.
unde 185,69 g/mole este masa moleculară a clorhidratului de metamfetamină.
Cunoscut sub denumirea de randament teoretic. Randamentul teoretic este cantitatea de substanță care trebuie să fie obținută ca rezultat al reacției. Prinurmare, puteți număra randamentul reacției din acest rezultat teoretic.
Cunoscut sub denumirea de randament teoretic. Randamentul teoretic este cantitatea de substanță care trebuie să fie obținută ca rezultat al reacției. Prinurmare, puteți număra randamentul reacției din acest rezultat teoretic.
Randament, % = (m(teoretic)*100)/m(practic),
Randament (MH) = (100 g * 100) / 137,56 = 72,7 %.
Randament (MH) = (100 g * 100) / 137,56 = 72,7 %.
După cum puteți vedea, randamentul real de 72,7 % este foarte diferit de randamentul de 100 %, care a fost calculat în mod eronat din masa de reacție. Acesta joacă un rol semnificativ în producerea oricărei substanțe.
Last edited:
