G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,966
- Solutions
- 3
- Reaction score
- 3,337
- Points
- 113
- Deals
- 1
Introdução
Como transformar gramas em mililitros e vice-versa?
O que são moles?
O que é a massa molar?
Como transformar moles em gramas e vice-versa?
Outro exemplo: tem de adicionar 10 moles de borohidreto de sódio (NaBH4) com 37,83 g/mol de massa molecular à reação e tem de o contar em gramas:
Como contar os reagentes?
Como contar o rendimento de uma reação?
Em seguida, conte quantos moles de um reagente de falta (P2P, neste exemplo) participam na reação.
Recebo muitas perguntas sobre rendimentos de reacções, quantidade de reagentes, como transformar uma dimensão noutra e noto que as pessoas não sabem contar corretamente estes números simples mas muito importantes. Decidi descrever os métodos correctos neste tópico. Se não perceberes alguma coisa, não hesites em perguntar e discutir as tuas questões na secção de comentários.
Como transformar gramas em mililitros e vice-versa?
O grama (símbolo da unidade SI g) é uma unidade de massa no SistemaInternacional de Unidades(SI) igual a um milésimo de um quilograma (1/1000). O gramaé o peso absoluto de um volume de água pura igual ao cubo da centésima parte de um metro [1 cm3], e à temperatura de fusão do gelo, a temperatura de definição (~0 °C) foi posteriormente alterada para 4 °C, a temperatura de densidade máxima da água.
Factores de conversão
Factores de conversão
- 1 grama (g) = 15,4323583529 grãos (gr).
- 1 grão (gr) = 0,06479891 gramas.
- 1 onça avoirdupois (oz) = 28,349523125 gramas.
- 1 onça troy (ozt) = 31,1034768 gramas.
- 100 gramas (g) = 3,527396195 onças (oz).
- 1 quilate (ct) = 0,2 gramas.
- 1 gama (γ) = 10-6 gramas.
- 1 undecimograma = 1 "décimo primeiro-grama" = 10-11 gramas no sistema histórico quadrante-elevado-grama-segundo (sistema QES) também conhecido como sistema hebdometro-undecimograma-segundo (sistema HUS).
- 500 gramas (g) = 1 jin nas unidades de medida chinesas.
O litro (ortografia internacional) ou litro (ortografia do inglês americano), símbolos SI L e l. O litro é uma unidade métrica de volume. É igual a 1 decímetro cúbico (dm3), 1000 centímetros cúbicos (cm3) ou 0,001 metro cúbico (m3). Um decímetro cúbico (ou litro) ocupa um volume de 10 cm × 10 cm × 10 cm (ver figura) e é, portanto, igual a um milésimo de um metro cúbico. Mililitro, símbolo SI ml ou mL é o centímetro cúbico. Um centímetro cúbico (ou ml) ocupa um volume de 1 cm × 1 cm × 1 cm e é, portanto, igual a um milésimo de um litro (1/1000).
Factores de conversão

Factores de conversão
- 1 litroimperial = 1,1365225 L.
- 1 U.S. quart = 0,946352946 L.
- 1 litroimperial = 0,56826125 L.
- 1 U.S. pint = 0,473176473 L.
- 1galão imperial = 4,54609 L.
- 1 galão americano =3,785411784 L.
- 1 pé cúbico = 28,316846592 L.
- 1 polegada cúbica = 0,016387064 L.
- 1 onça fluida imperial = 28,4130625 mL.
- 1 onça fluida americana = 29,5735295625 mL.
As gramas podem ser facilmente transformadas em mililitros de acordo com esta fórmula.
V = m / ρ.
em que m - massa da substância, g; ρ - densidade da substância, g/ml; V - volume da substância.
De acordo com esta fórmula, é possível transformar qualquer substância em volume e vice-versa. Por exemplo, temos 20 g de mercúrio (Hg) e queremos calcular a sua massa. ρ (Densidade) do mercúrio é 13,5 g/ml, pelo que
De acordo com esta fórmula, é possível transformar qualquer substância em volume e vice-versa. Por exemplo, temos 20 g de mercúrio (Hg) e queremos calcular a sua massa. ρ (Densidade) do mercúrio é 13,5 g/ml, pelo que
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml É o volume de 20 g de mercúrio.
O que são moles?
A mole, símbolo mol, n, é a unidade de quantidade de substância no Sistema Internacional de Unidades (SI). A quantidade de substância é uma medida de quantas entidades elementares de uma determinada substância se encontram num objeto ou amostra (em qualquer substância). A mole é definida como contendo exatamente 6,02214085774 × 10²³ partículas (átomos, moléculas, iões, electrões ou quaisquer outros objectos). Por exemplo, 10 moles de água (um composto químico H2O) e 10 moles de mercúrio (um elemento químico Hg), contêm quantidades iguais de substância e o mercúrio contém exatamente um átomo por cada molécula de água, apesar de os dois terem volumes diferentes e massas diferentes. De qualquer forma, é bastante, não é? Esta é a razão pela qual é mais conveniente saber como converter gramas em moles em vez de gramas em número de átomos.
O que é a massa molar?
A massa molar é uma caraterística de uma substância, a razão entre a massa de uma substância e a sua quantidade. Numericamente igual à massa de 1 mole de uma substância, ou seja, a massa de uma substância contém um número de partículas igual ao número de Avogadro. A massa molar, expressa em g/mol, coincide numericamente com a massa molecular, expressa em r.a.m., e com a massa atómica relativa. No entanto, existe uma diferença entre a massa molar e a massa molecular, sendo apenas numericamente iguais e diferindo em dimensão.
Por exemplo, a massa molar do oxigénio como elemento M(O) = 16 g/mol, mas como substância simples constituída por moléculas O2 = 32 g/mol.
As massas molares de moléculas complexas podem ser determinadas através da soma das massas molares dos seus elementos constituintes. Por exemplo, a massa molecular da água H2O é.
Por exemplo, a massa molar do oxigénio como elemento M(O) = 16 g/mol, mas como substância simples constituída por moléculas O2 = 32 g/mol.
As massas molares de moléculas complexas podem ser determinadas através da soma das massas molares dos seus elementos constituintes. Por exemplo, a massa molecular da água H2O é.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Como transformar moles em gramas e vice-versa?
Para avaliar corretamente o número de moles, n, de uma substância com uma massa específica, m, (em gramas), é necessário seguir a fórmula de gramas para moles.
n = m / M.
onde: M - a massa molar desse material. A unidade é normalmente g/mol; m - massa da substância, g; n - moles da substância, mol.
Por exemplo, tem 100 g de P2NP, que tem 163,17 g/mol de massa molecular. É necessário calcular a quantidade de moles. De acordo com a fórmula acima.
Por exemplo, tem 100 g de P2NP, que tem 163,17 g/mol de massa molecular. É necessário calcular a quantidade de moles. De acordo com a fórmula acima.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 moles.
Outro exemplo: tem de adicionar 10 moles de borohidreto de sódio (NaBH4) com 37,83 g/mol de massa molecular à reação e tem de o contar em gramas:
m(NaBH4) = 10 moles x 37,83 g/mol = 378,3 g.
Como contar os reagentes?
Abriu o manual de síntese e apercebeu-se de que precisa de uma síntese muito menor ou em maior escala. Está confuso com os números e não sabe como contá-los à sua escala? Há uma explicação.
Se quiser aumentar a escala de uma síntese e tiver a certeza de que é possível fazê-lo de acordo com a dependência linear, basta multiplicar todas as quantidades de reagentes pelo mesmo índice. Obterá as quantidades de reagentes para a sua escala de síntese e não precisa de perguntar a nenhum perito sobre isto!
Exemplo: quer realizar a síntese de anfetaminas através de NaBH4/CuCl2 e tem de utilizar 1000 g de P2NP para esta síntese, de acordo com o manual do fórum BB. Pretende efetuar uma carga de síntese de 150 g de P2NP. O seu algoritmo é.
Se quiser aumentar a escala de uma síntese e tiver a certeza de que é possível fazê-lo de acordo com a dependência linear, basta multiplicar todas as quantidades de reagentes pelo mesmo índice. Obterá as quantidades de reagentes para a sua escala de síntese e não precisa de perguntar a nenhum perito sobre isto!
Exemplo: quer realizar a síntese de anfetaminas através de NaBH4/CuCl2 e tem de utilizar 1000 g de P2NP para esta síntese, de acordo com o manual do fórum BB. Pretende efetuar uma carga de síntese de 150 g de P2NP. O seu algoritmo é.
1. Divida 1000 g da quantidade descrita no manual do precursor principal P2NP por 150 g e obterá o índice necessário 6,67.
2. Dividatodas as quantidades de reagentes por 6,67 e alcançará o seu objetivo.
Caso seja necessário aumentar a carga desta síntese de 1000 g de P2NP para 2500 g, siga estas instruções.
1. Divida2500 g de P2NP por 1000 g e obterá o índice 2,5.
2. Multiplique todos os reagentes por 2,5 e alcançará o seu objetivo.
Como contar o rendimento de uma reação?
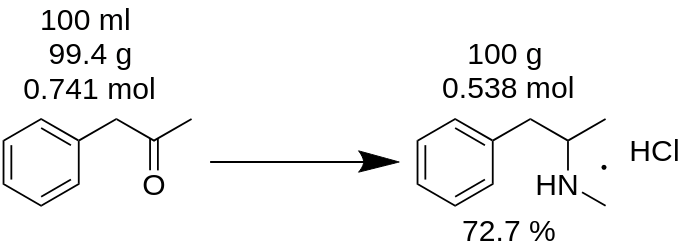
Efectuou a síntese de cloridrato de metanfetamina a partir de 100 ml de P2P e obteve 100 g de produto. Pensa que obteve um rendimento de 100%? Está errado!
Exemplo.
Exemplo.
Em primeiro lugar, é necessário contar a massa de P2P, que foi utilizada para esta síntese.
m(P2P) = 100 ml / 1,006 = 99,4g
Em seguida, conte quantos moles de um reagente de falta (P2P, neste exemplo) participam na reação.
n(P2P) = 99,4 g / 134,178 g/mole = 0,741 moles.
Um reagente em falta é um reagente que participa numa reação e que tem a menor quantidade de moles. Por exemplo, na reação de aminação redutora do P2P em metanfetamina, é necessário 1 mole de P2P e ~3,5 moles de metilamina. O P2P é o reagente em falta nesta reação.
De acordo com o equilíbrio da reação, 1 mole de P2P dá 1 mole de cloridrato de metanfetamina. Assim, 0,741 moles de P2P dão 0,741 moles de cloridrato de metanfetamina (MH), que é
De acordo com o equilíbrio da reação, 1 mole de P2P dá 1 mole de cloridrato de metanfetamina. Assim, 0,741 moles de P2P dão 0,741 moles de cloridrato de metanfetamina (MH), que é
m(MH) = 0,741 moles x 185,69 g/mole = 137,56 g.
em que 185,69 g/mole é a massa molecular do cloridrato de metanfetamina.
Em conhecido como rendimento teórico. O rendimento teórico é a quantidade de substância que deve ser obtida como resultado da reação. Por conseguinte, é possível contar o rendimento da reação apartir deste resultado teórico.
Em conhecido como rendimento teórico. O rendimento teórico é a quantidade de substância que deve ser obtida como resultado da reação. Por conseguinte, é possível contar o rendimento da reação apartir deste resultado teórico.
Rendimento, % = (m(teoria)*100)/m(prática),
Rendimento (MH) = (100 g * 100) / 137,56 = 72,7 %.
Rendimento (MH) = (100 g * 100) / 137,56 = 72,7 %.
Como pode ver, o rendimento real de 72,7 % é realmente diferente do rendimento de 100 %, que foi erradamente calculado a partir da massa da reação. Este rendimento desempenha um papel importante na produção de qualquer substância.
Last edited:
