G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,728
- Solutions
- 3
- Reaction score
- 2,888
- Points
- 113
- Deals
- 1
Sissejuhatus
Kuidas muuta grammid milliliitriteks ja vastupidi?
Mis on moolid?
Mis on molaarmass?
Kuidas muuta moolid grammideks ja vastupidi?
Teine näide: te peate lisama reaktsiooni 10 mooli naatriumborohüdriidi (NaBH4), mille molekulmass on 37,83 g/mol, ja te peate selle grammidesse arvutama:
Kuidas lugeda reagente?
Kuidas lugeda reaktsiooni saagist?
Seejärel loendage, kui palju moole reagendi puudumist (antud näites P2P) osaleb reaktsioonis.
Ma saan palju samu küsimusi reaktsioonide saagise, reaktiivide koguse ja ühe mõõtme muutmise kohta ning märkan, et inimesed ei oska neid lihtsaid, kuid väga olulisi numbreid õigesti lugeda. Otsustasin selles teemas kirjeldada õigeid meetodeid. Kui te ei mõista midagi, ärge kartke küsida ja arutada oma küsimusi kommentaaride sektsioonis.
Kuidas muuta grammid milliliitriteks ja vastupidi?
Gramm (SI-ühiku sümbol g) on massiühik rahvusvahelises mõõtühikute süsteemis(SI), mis on võrdne ühe tuhandikuga kilogrammist (1/1000). Gramm on puhta vee mahu absoluutne mass, mis on võrdne meetri sajandikosa kuubiku [1 cm3] ja sulava jää temperatuuril, määratlev temperatuur (~0 °C) on hiljem muudetud 4 °C-ks, mis on vee maksimaalse tiheduse temperatuur.
Ümberarvestustegurid
Ümberarvestustegurid
- 1 gramm (g) = 15,4323583529 tera (gr).
- 1 tera (gr) = 0,06479891 grammi.
- 1 avoirdupois-unts (oz) = 28,349523125 grammi.
- 1 troiunts (ozt) = 31,1034768 grammi.
- 100 grammi (g) = 3,527396195 untsi (oz).
- 1 karaat (ct) = 0,2 grammi.
- 1 gamma (γ) = 10-6 grammi.
- 1 undecimogramme = 1 "üheteistkümnendikgramm" = 10-11 grammi ajaloolises kvadrant-üheteistkümnendikgrammi-sekundisüsteemis (QES-süsteem) ehk hebdomeetri- ja undecimogramme-sekundisüsteemis (HUS-süsteem).
- 500 grammi (g) = 1 jin hiina mõõtühikutes.
Liiter (rahvusvaheline kirjaviis) või liiter (Ameerika inglise kirjaviis), SI-sümbolid L ja l. Liiter on metriline mahuühik. See on võrdne 1 kuupdetsimeetri (dm3), 1000 kuupsentimeetri (cm3) või 0,001 kuupmeetri (m3). Kuutodetsimeetri (või liitri) ruumala on 10 cm × 10 cm × 10 cm (vt joonis) ja seega võrdub ühe tuhandikuga kuupmeetrist. Milliliiter, SI-tähis ml või ml on kuupsentimeeter. Kuupsentimeetri (või ml) ruumala on 1 cm × 1 cm × 1 cm ja on seega võrdne ühe tuhandikuga liitrist (1/1000).
Ümberarvestustegurid

Ümberarvestustegurid
- 1 Imperial quart = 1,1365225 l.
- 1 U.S. quart = 0,946352946 L.
- 1 Imperial pint = 0,56826125 L.
- 1 U.S. pint = 0,473176473 L.
- 1 Imperial gallon = 4,54609 L.
- 1 USA gallon = 3,785411784 L.
- 1 kuupjalg = 28,316846592 L.
- 1 kuupmeetritoll = 0,016387064 L.
- 1 Imperial vedelikuunts = 28,4130625 ml.
- 1 USA vedelunts = 29,5735295625 mL.
Selle valemi järgi saabgrammid hõlpsasti muuta milliliitriteks.
V = m / ρ.
kus m - aine mass, g; ρ - aine tihedus, g/ml; V - aine maht.
Selle valemi järgi saab iga aine muuta mahuks ja vastupidi. Näiteks on teil 20 g elavhõbedat (Hg) ja te tahate arvutada selle massi. ρ (tihedus) on 13,5 g/ml, seega
Selle valemi järgi saab iga aine muuta mahuks ja vastupidi. Näiteks on teil 20 g elavhõbedat (Hg) ja te tahate arvutada selle massi. ρ (tihedus) on 13,5 g/ml, seega
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml on 20 g elavhõbeda ruumala.
Mis on moolid?
Mool, tähis mol, n, on aine koguse ühik rahvusvahelises mõõtühikute süsteemis (SI). Ainekogus on aine koguse mõõt, mis näitab, kui palju elementaarseid üksusi antud ainest on objektis või proovis (mis tahes aines). Mool on defineeritud nii, et see sisaldab täpselt 6,02214085774 × 10²³ osakesi (aatomeid, molekule, ioone, elektrone või muid objekte). Näiteks 10 mooli vett (keemiline ühend H2O) ja 10 mooli elavhõbedat (keemiline element Hg), sisaldavad võrdse koguse ainet ja elavhõbe sisaldab täpselt ühe aatomi iga vee molekuli kohta, hoolimata sellest, et neil kahel on erinevad ruumalad ja erinevad massid. Igatahes on see päris palju, kas pole? See on põhjus, miks on mugavam osata grammi ümber arvestada mooliks, mitte grammi aatomite arvuks.
Mis on molaarmass?
Molaarmass on aine omadus, aine massi ja selle koguse suhe. Arvuliselt võrdub aine 1 mooli massiga, st aine mass sisaldab Avogadro arvuga võrdset arvu osakesi. Molaarmass, väljendatuna g/mol, langeb arvuliselt kokku molekulmassiga, väljendatuna r.a.m., ja suhtelise aatommassiga. Molaarmass ja molekulmass on siiski erinevad, need on ainult arvuliselt võrdsed ja erinevad mõõtmete poolest.
Näiteks hapniku kui elemendi molaarmass M(O) = 16 g/mol, kuid kui molekulidest koosneva lihtsa aine O2 = 32 g/mol.
Komplekssete molekulide molaarmassid saab määrata, summeerides nende koostisainete molaarmassid. Näiteks vee H2O molekulmass on.
Näiteks hapniku kui elemendi molaarmass M(O) = 16 g/mol, kuid kui molekulidest koosneva lihtsa aine O2 = 32 g/mol.
Komplekssete molekulide molaarmassid saab määrata, summeerides nende koostisainete molaarmassid. Näiteks vee H2O molekulmass on.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Kuidas muuta moolid grammideks ja vastupidi?
Selleks, et õigesti hinnata konkreetse massiga m (grammides) aine moolide arvu n, tuleb järgida grammide ja moolide vahelist valemit.
n = m / M.
kus: M - selle aine molaarmass. Ühik on tavaliselt g/mol; m - aine mass, g; n - aine moolid, mol.
Näiteks on teil 100 g P2NP, mille molekulmass on 163,17 g/mol. Peate leidma, kui palju molekule see on. Vastavalt ülaltoodud valemile.
Näiteks on teil 100 g P2NP, mille molekulmass on 163,17 g/mol. Peate leidma, kui palju molekule see on. Vastavalt ülaltoodud valemile.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 mol.
Teine näide: te peate lisama reaktsiooni 10 mooli naatriumborohüdriidi (NaBH4), mille molekulmass on 37,83 g/mol, ja te peate selle grammidesse arvutama:
m(NaBH4) = 10 mool x 37,83 g/mol = 378,3 g.
Kuidas lugeda reagente?
Olete avanud sünteesi käsiraamatu ja olete aru saanud, et teil on vaja palju vähem või suuremahulisemat sünteesi. Te a segaduses numbritest ja ei tea, kuidas neid oma skaalale lugeda? On olemas selgitus.
Kui soovite suurendada sünteesi skaalat ja olete kindel, et seda on võimalik teha vastavalt lineaarsele sõltuvusele, peate lihtsalt korrutama kõik reaktiivide kogused sama indeksiga. Te saate reaktiivide kogused oma sünteesi skaala jaoks ja te ei pea selle kohta ühtegi eksperti küsima!
Näide: te soovite teostada amfetamiini sünteesi NaBH4/CuCl2 kaudu ja te peate võtma 1000 g P2NP-d selle sünteesi jaoks vastavalt BB foorumi juhendile. Te soovite teostada 150 g P2NP sünteesi koormust. Teie algoritm on.
Kui soovite suurendada sünteesi skaalat ja olete kindel, et seda on võimalik teha vastavalt lineaarsele sõltuvusele, peate lihtsalt korrutama kõik reaktiivide kogused sama indeksiga. Te saate reaktiivide kogused oma sünteesi skaala jaoks ja te ei pea selle kohta ühtegi eksperti küsima!
Näide: te soovite teostada amfetamiini sünteesi NaBH4/CuCl2 kaudu ja te peate võtma 1000 g P2NP-d selle sünteesi jaoks vastavalt BB foorumi juhendile. Te soovite teostada 150 g P2NP sünteesi koormust. Teie algoritm on.
1. Jagage 1000 g kirjeldatud käsiraamatus kirjeldatud peamise lähteaine P2NP kogus 150 g-ga ja saate vajaliku indeksi 6,67.
2. Jagage kõik reaktiivide kogused 6,67-ga ja te saavutate oma eesmärgi.
Kuiteil on vaja seda sünteesi koormust suurendada 1000 g P2NP-lt 2500 g-ni, järgige järgmisi juhiseid.
1. Jagage 2500 g P2NP 1000 g-ga ja saate indeksi 2,5.
2. Korrutage kõik reaktiivid 2,5ga ja jõuate oma eesmärgini.
Kuidas lugeda reaktsiooni saagist?
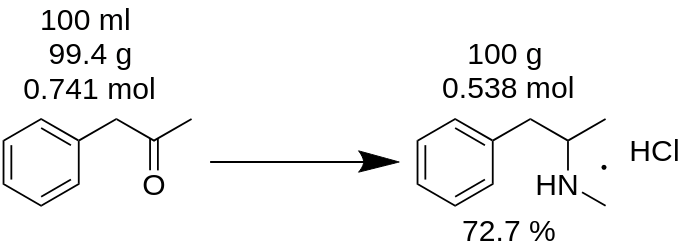
Te olete teostanud metamfetamiinvesinikkloriidi sünteesi 100 ml P2P-st ja saanud 100 g toodet. Te arvate, et saite 100% saagise? See on vale!
Näide.
Näide.
Kõigepealtpeate te loendama P2P massi, mida kasutati selle sünteesi jaoks.
m(P2P) = 100 ml / 1,006 = 99,4g
Seejärel loendage, kui palju moole reagendi puudumist (antud näites P2P) osaleb reaktsioonis.
n(P2P) = 99,4 g / 134,178 g/mool = 0,741 mooli.
Puudusreagent on reagent, mis osaleb reaktsioonis ja mille moolkogus on kõige väiksem. Näiteks P2P reduktiivse aminatsiooni reaktsioonis metamfetamiiniks tuleb võtta 1 mooli P2P-d ja ~3,5 mooli metüülamiini. P2P on selles reaktsioonis puuduv reaktiiv.
Vastavalt reaktsioonibilansile annab 1 mooli P2P 1 mooli metamfetamiinvesinikkloriidi. Seega annab 0,741 mooli P2P 0,741 mooli metamfetamiinvesinikkloriidi (MH),mis on
Vastavalt reaktsioonibilansile annab 1 mooli P2P 1 mooli metamfetamiinvesinikkloriidi. Seega annab 0,741 mooli P2P 0,741 mooli metamfetamiinvesinikkloriidi (MH),mis on
m(MH) = 0,741 mool x 185,69 g/mool = 137,56 g.
kus 185,69 g/mool on metamfetamiinvesinikkloriidi molekulmass.
Teoreetiline saagis. Teoreetiline saagis on aine kogus, mis tuleb saada reaktsiooni tulemusena. Seetõttusaab reaktsiooni saagist arvutada selle teoreetilise tulemuse põhjal.
Teoreetiline saagis. Teoreetiline saagis on aine kogus, mis tuleb saada reaktsiooni tulemusena. Seetõttusaab reaktsiooni saagist arvutada selle teoreetilise tulemuse põhjal.
Saagis, % = (m(teooria)*100)/m(praktika),
Saagis (MH) = (100 g * 100) / 137,56 = 72,7 %.
Saagis (MH) = (100 g * 100) / 137,56 = 72,7 %.
Nagu näete, on tegelik saagis 72,7 % tõesti erinev 100 % saagisest, mis arvutati ekslikult reaktsioonimassist. See maksab olulist rolli mis tahes aine tootmisel.
Last edited:
