G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,728
- Solutions
- 3
- Reaction score
- 2,888
- Points
- 113
- Deals
- 1
Introducción
¿Cómo convertir gramos en mililitros y viceversa?
¿Qué son los moles?
¿Qué es la masa molar?
¿Cómo convertir moles en gramos y viceversa?
Otro ejemplo, tienes que añadir 10 moles de borohidruro sódico (NaBH4) con 37,83 g/moles de masa molecular a la reacción y necesitas contarlo en gramos:
¿Cómo contar los reactivos?
¿Cómo contar el rendimiento de una reacción?
A continuación, cuenta cuántos moles de un reactivo faltante (P2P en este ejemplo) participan en la reacción.
Recibo muchas preguntas iguales sobre el rendimiento de las reacciones, la cantidad de reactivos, cómo pasar de una dimensión a otra y me doy cuenta de que la gente no sabe contar correctamente estos números sencillos pero muy importantes. He decidido describir los métodos correctos en este tema. Si no entiendes algo, no dudes en preguntar y discutir tus dudas en la sección de comentarios.
¿Cómo convertir gramos en mililitros y viceversa?
El gr amo (símbolo de unidad SI g) es una unidad de masa del SistemaInternacional de Unidades(SI) igual a la milésima parte de un kilogramo (1/1000). El gramo esel peso absoluto de un volumen de agua pura igual al cubo de la centésima parte de un metro [1 cm3], y a la temperatura de fusión del hielo, la temperatura definitoria (~0 °C) se cambió posteriormente a 4 °C, la temperatura de máxima densidad del agua.
Factores de conversión
Factores de conversión
- 1 gramo(g) = 15,4323583529 granos (gr).
- 1 grano(gr) = 0,06479891 gramos.
- 1 onzaavoirdupois (oz) = 28,349523125 gramos.
- 1 onzatroy (ozt) = 31,1034768 gramos.
- 100 gramos(g) = 3,527396195 onzas (oz).
- 1quilate (ct) = 0,2 gramos.
- 1gamma (γ) = 10-6 gramos.
- 1undecimogramo = 1 "undécimo-gramo" = 10-11 gramos en el sistema histórico cuadrante- undécimo-gramo-segundo (sistema QES) también conocido como sistema hebdómetro-undecimogramo-segundo (sistema HUS).
- 500 gramos (g) = 1 jin en las unidades de medida chinas.
El litro (ortografía internacional) o litro (ortografía del inglés americano), símbolos SI L y l. El litro es una unidad métrica de volumen. Equivale a 1 decímetro cúbico (dm3), 1000 centímetros cúbicos (cm3) o 0,001 metros cúbicos (m3). Un decímetro cúbico (o litro) ocupa un volumen de 10 cm × 10 cm × 10 cm (véase la figura) y equivale, por tanto, a la milésima parte de un metro cúbico. Mililitro, símbolo SI ml o mL es centímetro cúbico. Un centímetrocúbico (o ml) ocupa un volumen de 1 cm × 1 cm × 1 cm y equivale, por tanto, a la milésima parte de un litro (1/1000).
Factores de conversión

Factores de conversión
- 1litro imperial = 1,1365225 L.
- 1 cuarto de galón estadounidense = 0,946352946 L.
- 1 pinta imperial = 0,56826125 L.
- 1 pinta estadounidense = 0,473176473 L.
- 1 galón imperial =4,54609 L.
- 1 galón estadounidense =3,785411784 L.
- 1 pie cúbico =28,316846592 L.
- 1 pulgadacúbica= 0,016387064 L.
- 1 onza líquidaimperial = 28,4130625 ml.
- 1 onza líquidaestadounidense = 29,5735295625 ml.
Los gramos pueden convertirsefácilmente en mililitros segúnesta fórmula
V = m / ρ.
donde m - masa de la sustancia, g; ρ - densidad de la sustancia, g/ml; V - volumen de la sustancia.
Según esta fórmula, puedes convertir cualquier sustancia en volumen y viceversa. Por ejemplo, tienes 20 g de mercurio (Hg) y quieres calcular su masa. ρ (Densidad) del mercurio es 13,5 g/ml, por lo tanto
Según esta fórmula, puedes convertir cualquier sustancia en volumen y viceversa. Por ejemplo, tienes 20 g de mercurio (Hg) y quieres calcular su masa. ρ (Densidad) del mercurio es 13,5 g/ml, por lo tanto
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 mlEs el volumen de 20 g de mercurio.
¿Qué son los moles?
El mol, símbolo mol, n, es la unidad de cantidad de sustancia en el Sistema Internacional de Unidades (SI). La cantidad de sustancia es una medida de cuántas entidades elementales de una sustancia dada hay en un objeto o muestra (en cualquier sustancia). El mol se define como el que contiene exactamente 6,02214085774 × 10²³ partículas (átomos, moléculas, iones, electrones o cualquier otro objeto). Por ejemplo, 10 moles de agua (un compuesto químico H2O) y 10 moles de mercurio (un elemento químico Hg), contienen cantidades iguales de sustancia y el mercurio contiene exactamente un átomo por cada molécula del agua, a pesar de que ambos tienen volúmenes y masas diferentes. En cualquier caso, es bastante, ¿no? Poreso es más conveniente saber convertir gramos en moles que gramos en número de átomos.
¿Qué es la masa molar?
La masa molar es una característica de una sustancia, la relación entre la masa de una sustancia y su cantidad. Numéricamente es igual a la masa de 1 mol de una sustancia, es decir, la masa de una sustancia contiene un número de partículas igual al número de Avogadro. La masa molar, expresada en g/mol, coincide numéricamente con la masa molecular, expresada en r.a.m., y la masa atómica relativa. Sin embargo, hay diferencia entre la masa molar y la masa molecular, sólo son numéricamente iguales y difieren en dimensión.
Por ejemplo, la masa molar del oxígeno como elemento M(O) = 16 g/mol, pero como sustancia simple formada por moléculas O2 = 32 g/mol.
Las masas molares de las moléculas complejas pueden determinarse sumando las masas molares de sus elementos constituyentes. Por ejemplo, la masa molecular del agua H2O es
Por ejemplo, la masa molar del oxígeno como elemento M(O) = 16 g/mol, pero como sustancia simple formada por moléculas O2 = 32 g/mol.
Las masas molares de las moléculas complejas pueden determinarse sumando las masas molares de sus elementos constituyentes. Por ejemplo, la masa molecular del agua H2O es
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
¿Cómo convertir moles en gramos y viceversa?
Para evaluar correctamente el número de moles, n, de una sustancia de una masa determinada, m, (en gramos), hay que seguir la fórmula de gramos a moles.
n = m / M.
donde: M - la masa molar de este material. La unidad suele ser g/mol; m - masa de la sustancia, g; n - moles de la sustancia, mol.
Por ejemplo, tiene 100 g de P2NP, que tiene 163,17 g/mol de masa molecular. Necesitas contar cuántos moles son. Según la fórmula anterior
Por ejemplo, tiene 100 g de P2NP, que tiene 163,17 g/mol de masa molecular. Necesitas contar cuántos moles son. Según la fórmula anterior
n(P2NP) = 100 g / 163.17 g/mol = 0.6129 moles.
Otro ejemplo, tienes que añadir 10 moles de borohidruro sódico (NaBH4) con 37,83 g/moles de masa molecular a la reacción y necesitas contarlo en gramos:
m(NaBH4) = 10 moles x 37,83 g/mol = 378,3 g.
¿Cómo contar los reactivos?
Has abierto el manual de síntesis y te has dado cuenta de que necesitas una síntesis mucho menor o a mayor escala. ¿Te confunden los números y no sabes cómo contarlos a tu escala? Hay una explicación.
En caso de que quieras aumentar una escala de síntesis y estés seguro de que es posible hacerlo según la dependencia lineal, sólo tienes que multiplicar todas las cantidades de reactivos por el mismo índice. Obtendrá las cantidades de reactivos para su escala de síntesis y no necesitará preguntar a ningún experto sobre esto.
Ejemplo: quiere llevar a cabo la síntesis de anfetamina mediante NaBH4/CuCl2 y tiene que tomar 1000 g de P2NP para esta síntesis de acuerdo con el manual del foro BB. Usted quiere realizar una carga de síntesis de 150 g de P2NP. Su algoritmo es.
En caso de que quieras aumentar una escala de síntesis y estés seguro de que es posible hacerlo según la dependencia lineal, sólo tienes que multiplicar todas las cantidades de reactivos por el mismo índice. Obtendrá las cantidades de reactivos para su escala de síntesis y no necesitará preguntar a ningún experto sobre esto.
Ejemplo: quiere llevar a cabo la síntesis de anfetamina mediante NaBH4/CuCl2 y tiene que tomar 1000 g de P2NP para esta síntesis de acuerdo con el manual del foro BB. Usted quiere realizar una carga de síntesis de 150 g de P2NP. Su algoritmo es.
1. Divida 1000 g de la cantidad descrita en el manual del precursor principal P2NP por 150 g y obtendrá el índice necesario 6,67.
2. Dividatodas las cantidades de reactivos por 6.67 y alcanzará su objetivo.
En caso de que necesite ampliar esta carga de síntesis de 1000 g de P2NP a 2500 g, siga estas instrucciones.
1. Divide 2500 g de P2NP entre 1000 g y obtendrás el índice 2,5.
2. Multiplica todos los reactivos por 2,5 y alcanzarás tu objetivo.
¿Cómo contar el rendimiento de una reacción?
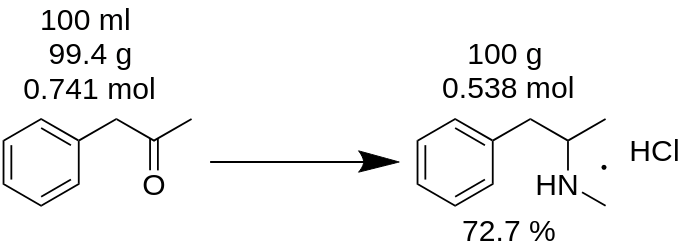
Has llevado a cabo la síntesis de clorhidrato de metanfetamina a partir de 100 ml de P2P y has obtenido 100 g del producto. ¿Crees que has obtenido un rendimiento del 100%? Es un error!
Ejemplo.
Ejemplo.
En primer lugar, tienes que contar la masa de P2P, que se utilizó para esta síntesis.
m(P2P) = 100 ml / 1,006 = 99,4g
A continuación, cuenta cuántos moles de un reactivo faltante (P2P en este ejemplo) participan en la reacción.
n(P2P) = 99,4 g / 134,178 g/ mol = 0,741 moles.
Un reactivo faltante es el reactivo que participa en una reacción y el que tiene la menor cantidad de moles. Por ejemplo, en la reacción de aminación reductora de P2P a metanfetamina, hay que tomar 1 mol de P2P y ~3,5 moles de metilamina. El P2P es el reactivo faltante en esta reacción.
De acuerdo con el balance de reacción, 1 mol de P2P da 1 mol de clorhidrato de metanfetamina. Por lo tanto, 0,741 moles de P2P dan 0,741 moles de clorhidrato de metanfetamina (MH), que es
De acuerdo con el balance de reacción, 1 mol de P2P da 1 mol de clorhidrato de metanfetamina. Por lo tanto, 0,741 moles de P2P dan 0,741 moles de clorhidrato de metanfetamina (MH), que es
m(MH) = 0,741 moles x 185,69 g/ mol = 137,56 g.
donde 185,69 g/ mol es la masa molecular del clorhidrato de metanfetamina.
Se conoce como rendimiento teórico. El rendimiento teórico es la cantidad de sustancia que debe obtenerse como resultado de la reacción. Porlo tanto, se puede contar el rendimiento de la reacción a partir de este resultado teórico.
Se conoce como rendimiento teórico. El rendimiento teórico es la cantidad de sustancia que debe obtenerse como resultado de la reacción. Porlo tanto, se puede contar el rendimiento de la reacción a partir de este resultado teórico.
Rendimiento, % = (m(teoría)*100)/m(práctica),
Rendimiento (MH) = (100 g * 100) / 137,56 = 72,7 %.
Rendimiento (MH) = (100 g * 100) / 137,56 = 72,7 %.
Como puede ver, el rendimiento real del 72,7 % es realmente diferente del rendimiento del 100 %, que se calculó erróneamente a partir de la masa de reacción. Desempeña un papel importante en la producción de cualquier sustancia.
Last edited:
