- Joined
- Jun 24, 2021
- Messages
- 1,644
- Solutions
- 2
- Reaction score
- 1,709
- Points
- 113
- Deals
- 666
Información general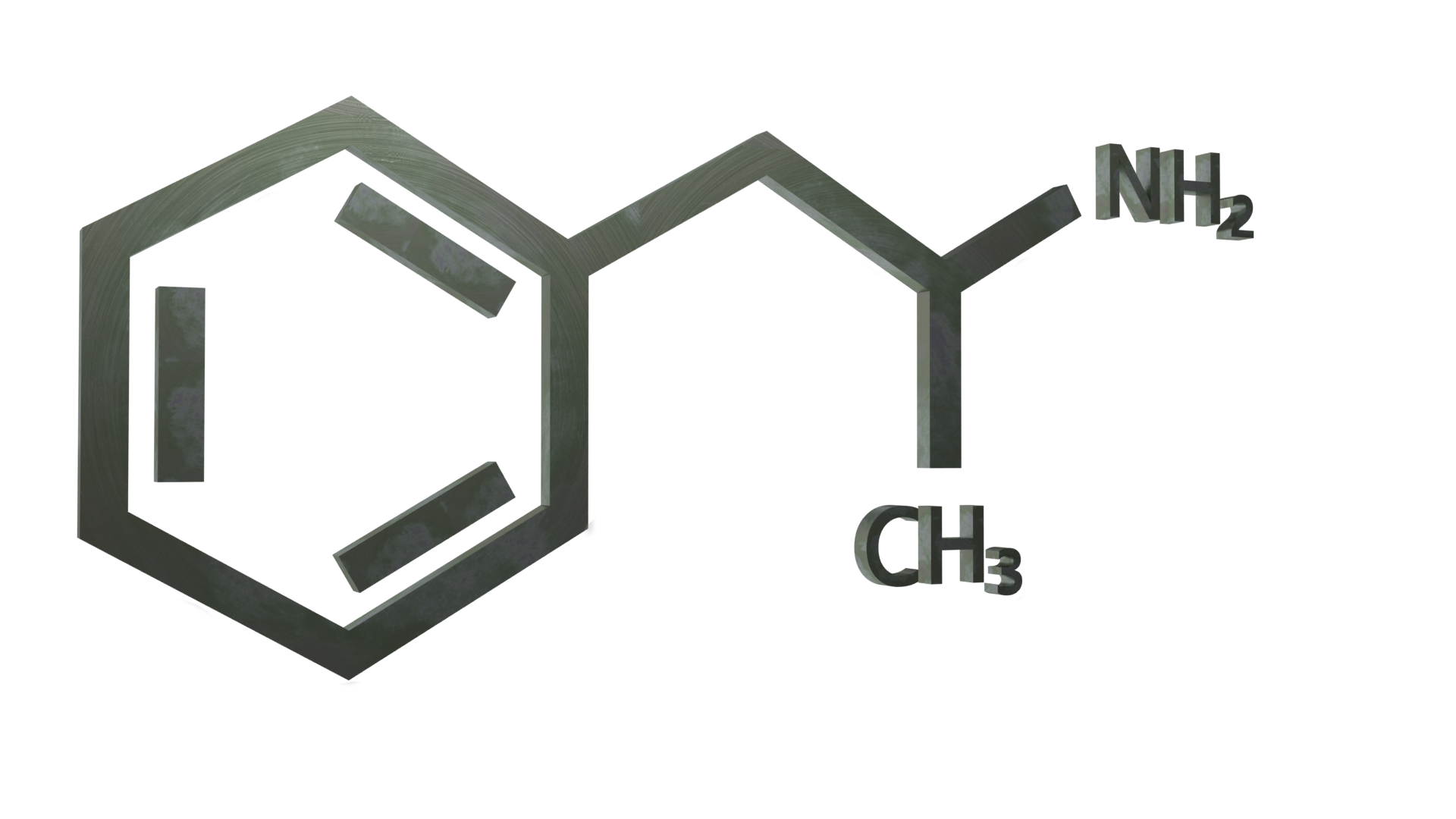
La anfetamina (también conocida como alfa-metilfenetilamina, anfetamina y speed) es una sustancia estimulante clásica de la clase de las fenetilaminas. Es el compuesto original de las anfetaminas sustituidas, un grupo diverso que incluye la metanfetamina, la MDMA, la catinona y el bupropión. Su mecanismo de acción consiste en promover la liberación de los neurotransmisores dopamina y norepinefrina.
La anfetamina, una sustancia descubierta hace más de 100 años, es una de las drogas controladas más restringidas. Anteriormente se utilizaba para una gran variedad de afecciones y esto cambió hasta este momento en el que su uso está muy restringido. La anfetamina, cuya fórmula química es alfa-metilfenetilamina, se descubrió en 1910 y se sintetizó por primera vez en 1927. Tras demostrarse que reduce la anestesia inducida por fármacos y produce excitación e insomnio, la mezcla racémica de anfetamina fue registrada por Smith, Kline y French en 1935. La estructura de la anfetamina presenta un centro quiral y existe en forma de dextro- y levo-isómeros. El primer producto de Smith, Kline and French fue aprobado por la FDA en 1976.
En la década de 1930, se vendía sin receta bajo el nombre de "Benzedrina" como descongestionante. Se generalizó su uso para tratar diversas dolencias, como la resaca del alcohol, la narcolepsia, la depresión y la obesidad. Durante la Segunda Guerra Mundial, la anfetamina se utilizó para promover la vigilia en los soldados. Este uso derivó en una gran sobreproducción de anfetamina y todo el excedente tras finalizar la guerra acabó en el mercado negro, produciendo el inicio del abuso. Debido a los problemas de adicción y abuso, finalmente se incluyó en la lista de sustancias controladas del "Convenio sobre Sustancias Psicotrópicas" de las Naciones Unidas de 1971.
En la actualidad, la anfetamina es principalmente un medicamento de venta con receta utilizado para tratar el trastorno por déficit de atención con hiperactividad (TDAH), la narcolepsia y la obesidad. Además, su uso ilícito está muy extendido como agente potenciador del rendimiento y sustancia recreativa.
Propiedades físicas
- Fórmula C9H13N
- Masa molar 135,210 g/mol
- Densidad 0,936 g/cm3 a 25 °C
- Punto de fusión 11,3 °C (52,3 °F)
- Punto de ebullición 200-203 °C (397 °F) a 760 mmHg
Propiedades químicas
La base libre de la anfetamina es un líquido aceitoso volátil incoloro con un característico olor a "pescado" y sabor acre y ardiente, poco soluble en agua, fácilmente soluble en disolventes orgánicos, punto de ebullición 200-203 °C.
La anfetamina es un homólogo metílico del neurotransmisor de los mamíferos fenetilamina con la fórmula química C9H13N. El átomo de carbono adyacente a la amina primaria es un centro estereogénico, y la anfetamina se compone de una mezcla racémica 1:1 de dos enantiómeros. Esta mezcla racémica puede separarse en sus isómeros ópticos: levoanfetamina y dextroanfetamina (isómeros l- y d-). Entre las sales sólidas de anfetamina que se preparan con frecuencia se encuentran el clorhidrato, el fosfato y el sulfato de anfetamina. El sulfato de dextroanfetamina es la sal enantiopura más común. La anfetamina es también el compuesto original de su propia clase estructural, que incluye una serie de derivados psicoactivos.
Formas de síntesis
Existe una lista de las formas más populares de síntesis de la anfetamina. Todas ellas tienen sus propias ventajas e inconvenientes. La síntesis no selectiva más popular es la reducción P2NP, que puede llevarse a cabo con amalgama de aluminio(Al). También es posible la reducción por NaBH4, LAH o gas hidrógeno con catalizador (PtO2 o Pd/C) y exceso de presión. El P2NP puede sintetizarse por simple condensación de nitroetano con benzaldehído.
Uno de los métodos más comunes de producción clandestina de anfetamina es la reacción de Leuckart, que consiste en la condensación de fenilacetona (fenil-2-propanona, P2P) con formamida o formiato de amonio en presencia de ácido fórmico y la posterior hidrólisis ácida de la N-formilanfetamina resultante.
También puede prepararse una mfetamina por aminación reductora de fenilacetona (P2P) en presencia de un catalizador metálico. La reacción procede con la formación de una imina intermedia. Ejemplos de reacción son: Reducción catalítica heterogénea de fenilacetona con amoníaco. El catalizador puede ser paladio sobre carbono, óxido de platino o níquel Raney. Restauración con amalgamas de aluminio, cinc o magnesio.
Si es necesario, los estereoisómeros de anfetamina dextroanfetamina y levoanfetamina pueden separarse utilizando ácido tartárico. Además, se ha publicado un método para la síntesis estereoselectiva de dextroanfetamina, que consiste en la aminación reductora de fenilacetona con S-α-metilbencilamina. La imina obtenida se reduce con Pd/C o níquel Raney y se recristaliza como clorhidrato. A continuación, el grupo N-bencil se hidrogenoliza en presencia de paladio sobre carbón para formar dextroanfetamina de gran pureza óptica.
Análisis y purificación
En cualquier forma de síntesis de la anfetamina se utilizan sustancias tóxicas y peligrosas. Existen dos métodos de purificación de la anfetamina " Lavado del producto" y un método más avanzado "Extracción ácido-base".
El lavado del producto es una parte esencial y final de casi cualquier síntesis. A veces se repite varias veces. El método está al alcance de cualquiera, no requiere habilidades, puede mejorar significativamente la calidad del producto y la presentación. El método es ideal para pequeñas cantidades. El lavado está indicado para residuos de P2NP, álcalis, ácidos, etc. El lavado no elimina los contaminantes (paracetamol, cafeína, etc.) ni las sales de mercurio.
Lo más accesible, y por tanto más fácil, es lavar la anfetamina con alcohol isopropílico (IPA). Más difícil de usar es la acetona anhidra. El IPA no contiene agua y, por tanto, no disuelve la sal de anfetamina. La clave del éxito del proceso es la falta de agua. Es necesario para evitar la disolución del anf con contaminantes, ya que se desecharán.
La extracción ácido-base (EBA), como método de purificación, permite obtener un medicamento de alta calidad. El método es bueno por el uso de reactivos, herramientas e instrumentos disponibles.
La anfetamina se corta inaceptablemente a menudo por cafeína, almidón, nootrópicos como Cinnarizine y Piracetam, a-PVP, metanfetamina y otros estimulantes y sustancias de farmacia. Existen varios métodos para comprobar su anfetamina. El más popular y sencillo es el de los reactivos para pruebas de drogas. Puedes leer sobre otros métodos en Protocolo de evaluación de anfetaminas.
Hay fotos de diferentes muestras de anfetamina después de las pruebas por reactivos
Efectos y dosis
Los efectos subjetivos incluyen estimulación, aumento de la concentración, aumento de la motivación, aumento de la libido, supresión del apetito y euforia. Suele tomarse por vía oral, pero también puede insuflarse, inyectarse o administrarse por vía rectal. Las dosis más bajas tienden a aumentar la concentración y la productividad, mientras que las dosis más altas tienden a aumentar la sociabilidad, el deseo sexual y la euforia.
La anfetamina tiene un alto potencial de abuso. El consumo crónico (es decir, dosis altas, administración repetida) se asocia con la redosificación compulsiva, el aumento de la tolerancia y la dependencia psicológica. Además, el abuso se ha relacionado con una serie de problemas de salud, especialmente cardiovasculares, como la hipertensión y el aumento del riesgo de ictus. Se recomienda encarecidamente utilizar prácticas de reducción de daños si se consume esta sustancia.
[Efectos físicos]
Estimulación - Se dice que la anfetamina es muy energética y estimulante. Puede estimular actividades físicas como bailar, socializar, correr o limpiar. El estilo particular de estimulación que produce la anfetamina puede describirse como forzado. Esto significa que a dosis más altas, resulta difícil o imposible mantenerse quieto. Se producen apretamientos de mandíbula, sacudidas corporales involuntarias y vibraciones, que dan lugar a sacudidas extremas de todo el cuerpo, inestabilidad de las manos y una pérdida general del control motor fino. Esto se sustituye por una leve fatiga y agotamiento general durante la compensación de la experiencia.
-
Sensaciones corporales espontáneas - El "subidón corporal" de la anfetamina puede describirse como una sensación de hormigueo eufórico moderado que abarca todo el cuerpo. Esta sensación mantiene una presencia constante que aumenta con el inicio y llega a su límite una vez alcanzado el pico.
-
Euforia física
-
Latidos anormales
-
Aumento de la frecuencia cardiaca
-
Aumento de la presion sanguinea- En alrededor de 30mmHg sistolica y 20mmHg diastolica, de usuarios ingenuos tomando 40mg de d-AMP.
-
Supresión del apetito
-
Broncodilatación
-
Deshidratación
-
Boca seca
-
Micción frecuente
-
Dificultad para orinar
-
Aumento de la temperatura corporal
-
Aumento de la sudoración
-
Manía - La anfetamina puede producir manía en individuos genéticamente predispuestos, como los que se encuentran en el espectro del trastorno bipolar o la esquizofrenia. Las dosis más altas y la privación de sueño parecen aumentar el riesgo.
-
Náuseas - Se pueden mitigar comiendo antes de la dosis y durante toda la experiencia.
-
Dilatación de la pupila - Este efecto sólo se experimenta con dosis altas y comunes y es más prominente en la fase de bajada.
-
Síncope reflejo
-
Aumento de la resistencia
-
Rechinar de dientes - El rechinar de dientes puede estar presente en dosis altas. Sin embargo, es menos intenso que el de la MDMA.
-
Disfunción eréctil temporal
-
Vasoconstricción - El consumo de anfetaminas provoca la constricción de los vasos sanguíneos, lo que hace que no llegue suficiente sangre a algunas partes del cuerpo. Esto puede causar sensación de hormigueo o dolor, sensación de frío, entumecimiento, palidez o cambios en el color de la piel, especialmente en los dedos de manos y pies.
[/SPOILER]
[SPOILER=Efecto visual]
-
Los efectos visuales de la anfetamina son inconsistentes y sólo son ligeramente perceptibles a dosis más altas. Son algo comparables a los efectos visuales delirantes y se producen más fácilmente en las zonas más oscuras.
[/SPOILER]
[SPOILER=Distorsiones]
-
Deriva - Este efecto es generalmente sutil y apenas perceptible y sólo se produce en dosis más altas o cuando se combina con el cannabis. Suele consistir en una deriva de nivel 1-2.
- Alteración de la luminosidad - La anfetamina puede hacer que los espacios parezcan más luminosos como resultado de sus efectos dilatadores de la pupila.
- Rastreadores - Este efecto es imperceptible con dosis bajas. Es mas pronunciado con dosis mayores y especialmente cuando alguien se priva del sueno, lo que por otro lado puede ser facilmente provocado por otros efectos de esta sustancia. Transformaciones - Este efecto ocurre muy raramente, y tipicamente solo cuando el usuario ha tomado dosis altas, esta bajando, o ha estado despierto por periodos inusualmente largos. Suelen ser muy leves cuando se producen.
[/SPOILER]
[SPOILER=Estados alucinatorios]
-
Transformaciones - Este efecto ocurre muy raramente, y típicamente sólo cuando el usuario ha tomado dosis altas, está bajando, o ha estado despierto durante períodos inusualmente largos. Suelen ser muy leves cuando se producen.
-
Geometría - Este efecto es reportado por algunos usuarios de anfetamina y sustancias relacionadas, típicamente en dosis más altas cuando uno está intentando dormir. Puede ser descrito en sus variaciones como simplista, algorítmico, sintético, poco iluminado, multicolor, brillante, bordes afilados, alejado, suave, angular, inmersivo y progresivo. Normalmente se produce en el nivel 3, aunque puede progresar al 4 y al 5 cuando se combina con sustancias como el cannabis o el DXM.
[/SPOILER]
[SPOILER=Efectos cognitivos]
- Potenciación del análisis
- Euforia cognitiva
- Redosificación compulsiva
- Inflación del ego
- Supresión de emociones - Este efecto suele ser más intenso en dosis ligeras y comunes, y es más común en el uso médico que en el recreativo.
- Aumento de la concentración: este efecto es más eficaz con dosis bajas o moderadas, ya que las dosis más altas suelen afectar a la concentración.
- Aumento de la libido - Aunque el consumo de anfetaminas puede provocar sensaciones de mejora sexual, la constricción de los vasos sanguíneos puede dificultar la obtención o el mantenimiento de una erección.
- Aumento de la apreciación musical
- Irritabilidad - Es más probable que esto ocurra con dosis más altas.
- Aumento de la memoria
- Aumento de la motivación
- Psicosis - Este efecto sólo se produce en individuos predispuestos, o tras un consumo crónico y de alta frecuencia, o debido a la privación de sueño.
- Supresión de la sugestionabilidad
- Aceleración del pensamiento
- Organización del pensamiento
- Distorsión del tiempo - Puede describirse como la experiencia de que el tiempo se acelera y pasa mucho más rápido de lo que lo haría normalmente estando sobrio.
- Vigilia
[/SPOILER]
[SPOILER=Efectos posteriores]
Los efectos que se producen durante la fase final de una experiencia estimulante suelen ser negativos e incómodos en comparación con los efectos que se producen durante el pico. Esto se conoce a menudo como "bajada" y se produce debido al agotamiento de los neurotransmisores. Sus efectos suelen incluir:
- Ansiedad - La ansiedad puede alcanzar niveles severos durante el "comedown" en algunos usuarios.
- Supresión del apetito
- Fatiga cognitiva
- Depresión
- Aumento de la frecuencia cardiaca - Mientras que la concentración de anfetamina en sangre y la mayoría de los efectos subjetivos son máximos unas 3 horas después de la administración, la frecuencia cardiaca alcanza su máximo mucho más tarde, a las 10 horas de la administración.
- Irritabilidad
- Supresión de la motivación
- Piernas inquietas
- Parálisis del sueño - Algunos usuarios notan parálisis del sueño después de consumir anfetamina.
- Supresión del sueño
- Desaceleración del pensamiento
- Desvelo - El insomnio que sigue a una serie repetida de dosis de anfetamina puede durar más de un día en algunos consumidores.
- Supresión de la motivación - Las experiencias pueden ir desde una desmotivación leve hasta estados extremos de desinterés. Este efecto es más prominente en dosis comunes y fuertes.
[/SPOILER]
Farmacología
La anfetamina ejerce sus efectos sobre el comportamiento aumentando la actividad de señalización de los neurotransmisores norepinefrina y dopamina en las vías de recompensa y función ejecutiva del cerebro. Los efectos reforzantes y motivadores de la anfetamina se deben principalmente a una mayor actividad dopaminérgica en la vía mesolímbica.
Los efectos euforizantes y estimulantes de la locomoción de la anfetamina dependen de la magnitud y la velocidad con la que aumenta las concentraciones sinápticas de dopamina y norepinefrina en el cuerpo estriado.
Es un potente agonista completo del receptor 1 asociado a la amina traza (TAAR1) e interactúa con el transportador vesicular de monoaminas 2 (VMAT2). La acción combinada sobre TAAR1 y VMAT2 produce un aumento de las concentraciones de dopamina y norepinefrina en las sinapsis, lo que estimula la actividad neuronal.
La dextroanfetamina es un agonista más potente del TAAR1 que la levoanfetamina. En consecuencia, la dextroanfetamina produce una mayor estimulación del SNC que la levoanfetamina, aproximadamente de tres a cuatro veces más, pero la levoanfetamina tiene efectos cardiovasculares y periféricos ligeramente más fuertes.
Se desconoce la biodisponibilidad exacta de la anfetamina, pero se cree que es superior al 75% por vía oral, y mayor por inyección o administración intranasal. Su absorción y excreción pueden depender del pH. Al tratarse de una base débil, cuanto más básico sea el entorno, más cantidad de fármaco se encontrará en forma liposoluble y se favorecerá la absorción a través de membranas celulares ricas en lípidos. La respuesta máxima de la anfetamina se produce 1-3 horas después de la administración oral y aproximadamente 15 minutos después de la inyección. La absorción completa de la anfetamina suele producirse al cabo de 4-6 horas. La forma básica se absorbe más fácilmente en el intestino y se elimina menos fácilmente por los riñones, lo que aumenta potencialmente su vida media. Los riñones la eliminan por excreción y una pequeña cantidad es eliminada por las enzimas hepáticas.
Datos del mercado ilegal
Oferta mundial de estimulantes de tipo anfetamínico (ETA)
En 2020 se incautó una cantidad récord de más de 525 toneladas de ETA, lo que representa un aumento del 15% con respecto al año 1 y mantuvo la tendencia al alza observada durante el período 2010-2020. Las cantidades de metanfetamina incautadas se quintuplicaron en ese período de 10 años, las cantidades de anfetamina incautadas casi se cuadruplicaron ylascantidades de "éxtasis" incautadas se triplicaron con creces.
El consumo de anfetaminas siguió aumentando, pero se observan signos de disminución de la demanda de tratamiento en 2020. Basándose principalmente en respuestas autodeclaradas a encuestas de población general, se calcula que un total de 34 millones de personas de entre 15 y 64 años, es decir, el 0,7% de la población mundial, han consumido anfetaminas en el último año, y que 20 millones (el 0,4%) han consumido sustancias del tipo del "éxtasis". Algunos de estos consumidores habían consumido ambos tipos de sustancias. Las dos anfetaminas más consumidas son la anfetamina y la metanfetamina.
La estimación mundial del consumo de anfetaminas fue similar en 2010, con 33 millones de consumidores en el último año o el 0,7% de la población de 15 a 64 años. Sin embargo, estas estimaciones deben interpretarse con cautela debido a la falta de datos de los principales países consumidores de Asia, donde otros indicadores del mercado, como las incautaciones y los precios, sugieren una expansión durante la última década. La información cualitativa basada en las percepciones de las tendencias comunicadas por expertos nacionales a la ONUDD muestra un aumento continuado tanto del consumo de anfetaminas como del número de personas en tratamiento por anfetaminas durante la última década. Sin embargo, los datos correspondientes a 2020 muestran que esta tendencia al alza se ha detenido y que el número de personas en tratamiento por anfetaminas puede haber disminuido, lo que concuerda con un descenso general del tratamiento como consecuencia de la pandemia de COVID-19. e Las tendencias derivadas de dicha información cualitativa concuerdan con los indicadores de oferta disponibles, como los precios y las incautaciones, que indican una continua expansión mundial del mercado de anfetaminas. La información cualitativa de este tipo adolece de limitaciones metodológicas, pero tiene la ventaja de que tiene en cuenta estudios a pequeña escala y observaciones de expertos sobre países en los que no se realizan encuestas periódicas sobre el consumo de drogas. La información cualitativa sobre las tendencias en el consumo de "éxtasis" fue comunicada en diferentes categorías por los países antes de la aplicación por parte de la UNODC de su nueva herramienta de recopilación de datos (el cuestionario actualizado para los informes anuales, que empezó a utilizarse en 2020), por lo que los informes cualitativos sobre las tendencias en el consumo de "éxtasis" se limitan al período 2019-2020. Estos informes sugieren un aumento moderado a nivel mundial. Al mismo tiempo, los estudios de países en los que el "éxtasis" se utiliza en entornos recreativos sugieren que el consumo de "éxtasis" disminuyó más que el de cualquier otra droga durante la pandemia en esos países. El análisis de las aguas residuales, aunque limitado en su cobertura geográfica a Europa, América del Norte y algunas partes de Asia y Oceanía, también sugiere que el consumo de "éxtasis" disminuyó entre 2019 y 2020 más que el consumo de anfetaminas. En la mayoría de los lugares analizados, se identificaron mayores niveles de consumo de MDMA, mientras que en una ligera mayoría de esos lugares, se detectó un aumento del consumo de anfetaminas y una disminución del consumo de metanfetaminas. Los primeros datos de análisis de aguas residuales de 2021 sugieren un aumento general del consumo de anfetaminas en la mayoría de los lugares vigilados por el grupo CORe de análisis de aguas residuales, la mayoría de los cuales se encuentran en Europa, entre 2020 y 2021; un aumento y un descenso del consumo de metanfetamina en aproximadamente el mismo número de lugares; y un descenso continuo del consumo de MDMA en una gran mayoría de lugares.
