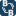Hier erkläre ich es Ihnen so einfach, dass Sie es nicht vermasseln können.
Wenn es darum geht, die Enantiomere einer beliebigen Chorchemikalie durch Kristallisation zu trennen, sind die optisch aktiven Isomere aktiver. Was bedeutet das?
1. Optisch aktiv bedeutet, dass das Molekül polarisiertes Licht biegt. Verbindungen, bei denen sich die Chiralität der Moleküle im Uhrzeigersinn dreht, wenn man die Kohlenstoffatome betrachtet, werden als R
Verbindungen, deren Seitenketten sich gegen den Uhrzeigersinn drehen, werden als S bezeichnet. Damit das klar ist: Ich stelle mir eine Verbindung vor, wenn ich die Kohlenstoffkette von c-1 abwärts betrachte; c-1 ohne Seitenkette. 3-2, eine Methylgruppe, die ungefähr an der 2-Uhr-Position abhängt, 2R-Methyl. Voller Stopp. Nächstes c-3. Der dritte Kohlenstoff in der Kette hat ein Hydroxyl-Molekül, das bei 6 Uhr herauskommt. 3R-Hydroxy. Dieses Molekül ist optisch aktiv, es beugt das Licht im Uhrzeigersinn.
Gehen wir nun ein Kohlenstoffatom zurück. Zurück zu C-3. Wenn ich sage, dass C-3:eine Hydroxyl-Seitenkette hat, die von dem Kohlenstoff bei etwa 9 Uhr ausgeht, 3Shydroxy. Dieses Molekül ist NICHT OPTISCH AKTIV. Es beginnt im Uhrzeigersinn und geht dann gegen den Uhrzeigersinn, so dass die Netto-Chiralität 0 ist, weil sie sich aufheben.
Dies ist eine theoretische Überlegung zu Demonstrationszwecken. Wenn C-2 eine Kette bei 3 Uhr und C-3 eine Hydroxygruppe bei 10 Uhr hat. Das Molekül ist immer noch 2R,3S, aber es ist optisch aktiv, denn wenn man die Winkel berücksichtigt, ergibt sich ein Nettogewinn, der das Molekül im Uhrzeigersinn bis etwa 1 Uhr dreht. Etwas mit einem höheren Gesamtspin wäre aktiver und würde zuerst kristallisieren
S, S aktiv
S. R. nicht aktiv
R, S nicht aktiv
R, R aktiv
ABER DENKEN SIE DARAN, dass wir hier über DIASTEROISOMERE sprechen, nicht über Isomere und nicht über Enantiomere.
R=D
S=l
Racemische Meth= D, L chirale Säure hinzufügen. Nehmen wir l-Weinsäure, da sie billig und natürlich ist
D-Meth+l-Weinsäure=
D, l-Meth-Weinstein
L-Meth+l-Weinsäure=
L,Meth-Tartrat
L-Methylamphetamin-L-tartat kristallisiert zuerst. Die Leckerbissen bleiben in der Suppe.
Ich möchte mich bei D. L. Desoxyephedrin für die Gelegenheit bedanken, heute zu Ihnen sprechen zu können. Es ist 6:39 Uhr.