G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,728
- Solutions
- 3
- Reaction score
- 2,888
- Points
- 113
- Deals
- 1
Indledning
Hvordan omregner man gram til milliliter og omvendt?
Hvad er mol?
Hvad er molarmasse?
Hvordan omregner man mol til gram og omvendt?
Etandet eksempel: Du skal tilsætte 10 mol natriumborhydrid (NaBH4) med en molekylmasse på 37,83 g/mol til reaktionen, og du skal regne det om til gram:
Hvordan tæller man reagenser?
Hvordan tæller man et reaktionsudbytte?
Derefter skal du tælle, hvor mange mol af et manglende reagens (P2P i dette eksempel), der deltager i reaktionen.
Jeg får mange af de samme spørgsmål om reaktionsudbytter, mængden af reagenser, hvordan man vender en dimension til en anden, og jeg bemærker, at folk ikke ved, hvordan man tæller disse enkle, men meget vigtige tal korrekt. Jeg har besluttet at beskrive de korrekte metoder i dette emne. Hvis der er noget, du ikke forstår, så tøv ikke med at stille og diskutere dine spørgsmål i kommentarfeltet.
Hvordan omregner man gram til milliliter og omvendt?
Gram (SI-enhedssymbol g) er en masseenhed i det internationale enhedssystem(SI), der svarer til en tusindedel af et kilogram (1/1000). Gram er den absolutte vægt af et volumen rent vand svarende til terningen af en hundrededel af en meter [1 cm3], og ved temperaturen for smeltende is blev den definerende temperatur (~0 °C) senere ændret til 4 °C, temperaturen for vands maksimale densitet.
Omregningsfaktorer
Omregningsfaktorer
- 1 gram (g) = 15,4323583529 grains (gr).
- 1 grain (gr) = 0,06479891 gram.
- 1 avoirdupois ounce (oz) = 28,349523125 gram.
- 1 troy ounce (ozt) = 31,1034768 gram.
- 100 gram (g) = 3,527396195 ounces(oz).
- 1 karat (ct) = 0,2 gram.
- 1 gamma (γ) = 10-6 gram.
- 1 undecimogram = 1 "ellevte gram" = 10-11 gram i det historiske kvadrant-elevte-gram-sekund-system (QES-systemet) alias hebdometre-undecimogram-sekund-systemet (HUS-systemet).
- 500 gram (g) = 1 jin i de kinesiske måleenheder.
Liter (international stavemåde) eller liter (amerikansk-engelsk stavemåde), SI-symboler L og l. Liter er en metrisk volumenenhed. Den svarer til 1 kubikdecimeter (dm3), 1000 kubikcentimeter (cm3) eller 0,001 kubikmeter (m3). En kubikdecimeter (eller liter) har et volumen på 10 cm × 10 cm × 10 cm (se figur) og svarer dermed til en tusindedel af en kubikmeter. Milliliter, SI-symbol ml eller mL er kubikcentimeter. En kubikcentimeter (eller ml) har et volumen på 1 cm × 1 cm × 1 cm og svarer således til en tusindedel af en liter (1/1000).
Omregningsfaktorer

Omregningsfaktorer
- 1 Imperial quart = 1,1365225 L.
- 1 U.S. quart = 0,946352946 L.
- 1 Imperial pint = 0,56826125 L.
- 1 U.S. pint = 0,473176473 L.
- 1 imperialgallon = 4,54609 l.
- 1 U.S. gallon = 3,785411784 L.
- 1 kubikfod = 28,316846592 L.
- 1 kubiktomme = 0,016387064 L.
- 1 Imperial fluid ounce = 28,4130625 mL.
- 1 U.S. fluid ounce = 29,5735295625 mL.
Gram kan let omregnes til milliliter efterdenne formel.
V = m / ρ.
hvor m - stoffets masse, g; ρ - stoffets massefylde, g/ml; V - stoffets volumen.
Ifølge denne formel kan du omdanne alle stoffer til volumen og omvendt. For eksempelhar du 20 g kviksølv (Hg), og du vil beregne dets masse.ρ (kviksølvs massefylde) er 13,5 g/ml, og derfor er
Ifølge denne formel kan du omdanne alle stoffer til volumen og omvendt. For eksempelhar du 20 g kviksølv (Hg), og du vil beregne dets masse.ρ (kviksølvs massefylde) er 13,5 g/ml, og derfor er
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml er volumen af 20 g kviksølv.
Hvad er mol?
Molet, symbolet mol, n, er enheden for stofmængde i det internationale enhedssystem (SI). Stofmængden er et mål for, hvor mange elementære enheder af et givet stof der er i et objekt eller en prøve (i et hvilket som helst stof). Et mol defineres som indeholdende præcis 6,02214085774 × 10²³ partikler (atomer, molekyler, ioner, elektroner eller andre objekter). For eksempel indeholder 10 mol vand (en kemisk forbindelse H2O) og 10 mol kviksølv (et kemisk grundstof Hg) lige store mængder stof, og kviksølvet indeholder nøjagtigt ét atom for hvert molekyle vand, på trods af at de to har forskellige volumener og forskellige masser. Det er alligevel ret meget, ikke? Det er grunden til, at det ermere praktisk at vide, hvordan man omregner gram til mol i stedet for gram til antal atomer.
Hvad er molarmasse?
Molarmasse er en egenskab ved et stof, forholdet mellem et stofs masse og dets mængde. Numerisk lig med massen af 1 mol af et stof, det vil sige, at massen af et stof indeholder et antal partikler, der er lig med Avogadros tal. Molarmassen, udtrykt i g/mol, er numerisk sammenfaldende med molekylmassen, udtrykt i r.a.m., og den relative atommasse. Der er dog forskel på molarmasse og molekylmasse, de er kun numerisk ens og har forskellige dimensioner.
For eksempel er molarmassen af ilt som grundstof M(O) = 16 g/mol, men som et simpelt stof bestående af molekyler O2 = 32 g/mol.
Molarmasserne af komplekse molekyler kan bestemmes ved at summere molarmasserne af deres bestanddele. For eksempel er molekylmassen af vand H2O.
For eksempel er molarmassen af ilt som grundstof M(O) = 16 g/mol, men som et simpelt stof bestående af molekyler O2 = 32 g/mol.
Molarmasserne af komplekse molekyler kan bestemmes ved at summere molarmasserne af deres bestanddele. For eksempel er molekylmassen af vand H2O.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Hvordan omregner man mol til gram og omvendt?
For at vurdere antallet af mol, n, af et stof med en bestemt masse, m, (i gram) korrekt, skal du følge formlen fra gram til mol.
n = m / M.
hvor: M - den molare masse af dette materiale. Enheden er typisk g/mol; m - stoffets masse, g; n - stoffets mol, mol.
Du har f.eks. 100 g P2NP, som har en molekylmasse på 163,17 g/mol. Du skal finde ud af, hvor mange mol det er. Ihenhold til formlen ovenfor.
Du har f.eks. 100 g P2NP, som har en molekylmasse på 163,17 g/mol. Du skal finde ud af, hvor mange mol det er. Ihenhold til formlen ovenfor.
n(P2NP)= 100 g / 163,17 g/mol = 0,6129 mol.
Etandet eksempel: Du skal tilsætte 10 mol natriumborhydrid (NaBH4) med en molekylmasse på 37,83 g/mol til reaktionen, og du skal regne det om til gram:
m(NaBH4) = 10 mol x 37,83 g/mol = 378,3 g.
Hvordan tæller man reagenser?
Du har åbnet syntesevejledningen og indset, at du har brug for en meget mindre eller større syntese. Du er forvirret over tallene og ved ikke, hvordan du skal tælle dem til din skala? Der er en forklaring.
Hvis du vil øge en synteseskala, og du er sikker på, at det er muligt at gøre det i henhold til lineær afhængighed, skal du bare gange alle reagensmængder med det samme indeks. Du får mængder af reagenser til din synteseskala, og du behøver ikke at spørge nogen ekspert om dette!
Eksempel : Du ønsker at udføre amfetaminsyntese via NaBH4/CuCl2, og du skal tage 1000 g P2NP til denne syntese i henhold til manualen fra BB-forum. Du ønsker at udføre 150 g P2NP-syntesebelastning. Din algoritme er.
Hvis du vil øge en synteseskala, og du er sikker på, at det er muligt at gøre det i henhold til lineær afhængighed, skal du bare gange alle reagensmængder med det samme indeks. Du får mængder af reagenser til din synteseskala, og du behøver ikke at spørge nogen ekspert om dette!
Eksempel : Du ønsker at udføre amfetaminsyntese via NaBH4/CuCl2, og du skal tage 1000 g P2NP til denne syntese i henhold til manualen fra BB-forum. Du ønsker at udføre 150 g P2NP-syntesebelastning. Din algoritme er.
1. Divider 1000 g beskrevet i den manuelle mængde hovedprækursor P2NP med 150 g, og du får det nødvendige indeks 6,67.
2. Divider alle reagensmængder med 6,67, så når du dit mål.
Hvisdu har brug for at opskalere denne syntese fra 1000 g P2NP til 2500 g, skal du følge disse instruktioner.
1. Divider 2500 g P2NP med 1000 g, så får du indeks 2,5.
2. Multiplicer alle reagenser med 2,5, så når du dit mål.
Hvordan tæller man et reaktionsudbytte?
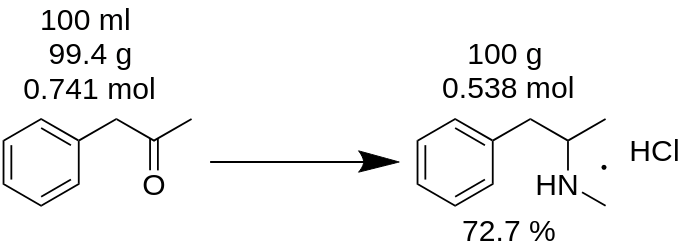
Du har udført metamfetaminhydrokloridsyntese fra 100 ml P2P og fået 100 g af produktet. Tror du, at du har fået 100 % udbytte? Det er forkert!
Eksempel.
Eksempel.
Først og fremmest skal du tælle massen af P2P, som blev brugt til denne syntese.
m(P2P) = 100 ml / 1,006 = 99,4 g
Derefter skal du tælle, hvor mange mol af et manglende reagens (P2P i dette eksempel), der deltager i reaktionen.
n(P2P)= 99,4 g / 134,178 g/mol = 0,741 mol.
En mangelreagens er en reagens, som deltager i en reaktion, og som har den mindste molmængde. For eksempel skal du i reaktionen med P2P-reduktiv aminering til metamfetamin tage 1 mol P2P og ~3,5 mol methylamin. P2P er den manglende reagens i denne reaktion.
Ifølge reaktionsbalancen giver 1 mol P2P 1 mol metamfetaminhydrochlorid. Derfor giver 0,741 mol P2P 0,741 mol metamfetaminhydrochlorid (MH), hvilket er
Ifølge reaktionsbalancen giver 1 mol P2P 1 mol metamfetaminhydrochlorid. Derfor giver 0,741 mol P2P 0,741 mol metamfetaminhydrochlorid (MH), hvilket er
m(MH) = 0,741 mol x 185,69 g/mol = 137,56 g.
hvor 185,69 g/mol er molekylmassen af metamfetaminhydrochlorid.
Kendes som teoretisk udbytte. Teoretisk udbytte er den mængde stof, der skal opnås som reaktionsresultat. Derfor kan du beregne reaktionsudbyttet ud fra dette teoretiske resultat.
Kendes som teoretisk udbytte. Teoretisk udbytte er den mængde stof, der skal opnås som reaktionsresultat. Derfor kan du beregne reaktionsudbyttet ud fra dette teoretiske resultat.
Udbytte,% = (m(teori)*100)/m(praksis),
Udbytte (MH) = (100 g * 100) / 137,56 = 72,7 %.
Udbytte (MH) = (100 g * 100) / 137,56 = 72,7 %.
Som du kan se, er det reelle udbytte på 72,7 % virkelig forskelligt fra 100 % udbytte, som fejlagtigt blev beregnet ud fra reaktionsmassen. Det spiller en vigtig rolle i enhver stofproduktion.
Last edited:
