G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,727
- Solutions
- 3
- Reaction score
- 2,886
- Points
- 113
- Deals
- 1
Úvod
Kyselina lysergová, základní fragment odvozený od námelových alkaloidů, byla syntetizována ve čtrnáctistupňovém pořadí počínaje 3-beta-karboxyethylindolem. Výchozí materiál byl převeden na meziprodukt 1-benzoyl-5-keto-1,2,2a-3,4,5-hexahydrobenz-[cd]-indol (3), obsahující tři ze čtyř kruhů přítomných v kyselině lysergové. Tento keton se zase přeměnil na tetracyklickou sloučeninu, 9-keto-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4.3-fe]-chinolin (8), a odtud na kyselinu lysergovou (14). Tato syntéza není jednoduchá a vyžaduje velké laboratorní zkušenosti a znalosti chemie. Navíc je zde několik manipulací s nebezpečnými látkami, které musí být prováděny za přísných bezpečnostních opatření.
Bod varu: 536,2 ± 50,0 °C při 760 mm Hg;
Bod tání: 240 °C;
Molekulová hmotnost: 268,31 g/mol;
Hustota: 1,4 ± 0,1 g/ml;
Číslo CAS: 82-58-6.
Vybavení a skleněné nádobí:
- Ocelový hydrogenační reaktor 2-3 l;
- Ocelový autokláv 500 ml;
- Laboratorní váhy (vhodné od 0,01 do 500 g);
- baňky s kulatým dnem 100, 200, 500 ml, 5 a 10 l;
- Vodíkový (H2) kompresor a původ;
- Buchnerova baňka a nálevka (velká) 5 l [pro malá množství lze použít Schottův filtr];
- Rotovap stroj (velký);
- Zdroj vakua;
- Oddělovací nálevky 500 ml a 2 l;
- Dusíkový balón ~50-70 l (1 bar);
- Uzávěry se zátkou pro baňky;
- Slaná ledová vodní lázeň;
- 5 L x2, 2 L x2; 1 L x2; 500 ml x2; 100 ml x3; 50 ml x2 Kádinky;
- Skleněná stříkačka nebo Pasteurova pipeta;
- Magnetické míchadlo nebo horní míchadlo;
- Vakuová destilační souprava;
- zpětný chladič;
- Retortový stojan a svorka pro upevnění přístroje;
- laboratorní teploměr (-20 °C až 200 °C) s adaptérem na baňku;
- Indikátorový papír pH;
- Skleněná tyčinka a špachtle;
- 250 wattová žárovka.
Reagencie.
- Kyselina 3-indolepropionová (1), 94,6 g (0,5 mol);
- 9,5 l destilované vody (H2O);
- ~400 g hydroxidu sodného (NaOH);
- 116 g Raneyho niklu (Ni);
- 1050 ml koncentrované kyseliny chlorovodíkové (HCl);
- 2 ml kyseliny sírové (H2SO4 conc.);
- 210 ml 12N aq roztoku hydroxidu sodného (NaOH);
- 180 ml benzoylchloridu;
- ~1,5 l methanolu (MeOH);
- ~1,6 l ethanolu (EtOH);
- 201,2 ml thionylchloridu (SOCl2);
- 1950 ml disulfidu uhličitého (CS2);
- 240 g chloridu hlinitého (AlCl3);
- 2,5 l benzenu;
- 500 ml 2N hydroxidu sodného (NaOH);
- ~3,2 l diethyletheru (Et2O);
- 3,3 L ledová kyselina octová (AcOH);
- 352 g (1,1 mol) hydrobromidu pyridinu perbromidu;
- 5 L chloroformu (CHCl3);
- ~1000 g síranu hořečnatého (MgSO4);
- 307 g (2,35 mol) methylaminoaceton ethylen ketal (5);
- 4,5 l benzenu;
- ~500 g Aktivní uhlí (C);
- ~1 l acetonu;
- ~500 g Hydrogenuhličitan sodný (NaHCO3);
- 80 ml Studený anhydrid octový (Ac2O);
- 1,5 g borohydridu sodného (NaBH4);
- 75 ml oxidu siřičitého (kapalina SO2);
- 40 g kyanidu sodného (NaCN prášek);
- 300 ml kyanovodíku (HCN kapalina);
- 78 ml 1,5% vodného roztoku hydroxidu draselného (KOH);
- 8,5 g hydratovaného arzeničnanu sodného;
- ~ 50 ml xylenu;
- 100 ml zředěného roztoku hydroxidu amonného (NH4OH);
- 16,9 g methoxidu sodného (MeONa).
Postup
1-Benzoyl-3-(beta-karboxyethyl)-2,3-dihydroindol (2)Kyselina 3-indolepropionová (1), 94,6 g (0,5 mol), byla rozpuštěna v 600 ml vody obsahující 20 g hydroxidu sodného. Roztok byl smíchán s přibližně 100 g niklového katalyzátoru Raney a hydrogenován při RT v ocelové hydrogenační bombě o objemu 2-3 l při tlaku 3000-4000 psi (207-276 barů) H2. Redukce byla obvykle dokončena za 20-30 h, poté byl katalyzátor přefiltrován a promyt trochou vody. K filtrátu byla přidána koncentrovaná kyselina HCl v množství 85 ml a roztok byl ochlazen. Pokud byla redukce neúplná, oddělila se v tomto okamžiku nezreagovaná kyselina indol-propionová a byla odstraněna filtrací. Filtrát byl poté benzoylován obvyklým Schotten-Baumannovým postupem za použití 210 ml 12N hydroxidu sodného a 180 ml benzoylchloridu. Roztok byl po celou dobu benzoylace udržován alkalický a teplota byla udržována pod 40 °C chlazením. Po úplné reakci benzoylchloridu byla směs ochlazena a okyselena 300 ml koncentrované kyseliny HCl. Surový produkt byl přefiltrován a promyt vodou, poté byl extrahován 4 x 1 l dávkami horké vody, aby se odstranila kyselina benzoová. Horký sirupovitý produkt (2) byl po dekantaci vodného extraktu vykrystalizován z několika objemů methanolu; výtěžek 103 g (70 %), MP: 151-153 °C.
1-Benzoyl-5-keto-1,2,2a,3,4,5-hexahydrobenz-[cd]-indol (3)
1-Benzoyl-3-(beta-karboxyethyl)-2,3-dihydroindol (2), 118 g (0,4 mol), byl smíchán s 200 ml čistého thionylchloridu. Roztok se nechal 30 min stát a poté se 15-20 min mírně zahříval na parní lázni. Přebytečný thionylchlorid byl zcela odpařen pod 30 °C ve vakuu a surový chlorid kyseliny byl rozpuštěn ve 200 ml disulfidu uhličitého. Roztok chloridu kyseliny byl poté tenkým proudem přidán k intenzivně míchané suspenzi 240 g chloridu hlinitého v 1750 ml disulfidu uhličitého, která se nacházela v 5l baňce (v KAPALINĚ!!!). Došlo k oddělení komplexu a míchání bylo obtížné. Směs byla zahřívána pod zpětným chladičem a míchána po dobu jedné hodiny, aby byla reakce dokončena, poté byla velmi opatrně rozložena přidáním 500 g ledu, 250 ml kyseliny HCl a 500 ml vody. Během rozkladu bylo udržováno míchání a chlazení bylo ovlivňováno pravidelnou destilací disulfidu uhličitého ve vakuu a produkt byl extrahován 2 l benzenu. Extrakt byl důkladně promyt 500 ml 2N hydroxidu sodného ve třech dávkách a poté vodou. Byl vysušen nad síranem hořečnatým a poté odpařen na malý objem ve vakuu. Pomalé přidávání několika objemů etheru způsobilo krystalizaci žlutého ketonu (3) . Byl zfiltrován a promyt etherem; výtěžek 85,3 g (77 %), MP: 146-147 °C. Vzorek byl rekrystalizován pro analýzu z benzenetheru.
1-Benzoyl-3-(beta-karboxyethyl)-2,3-dihydroindol (2), 118 g (0,4 mol), byl smíchán s 200 ml čistého thionylchloridu. Roztok se nechal 30 min stát a poté se 15-20 min mírně zahříval na parní lázni. Přebytečný thionylchlorid byl zcela odpařen pod 30 °C ve vakuu a surový chlorid kyseliny byl rozpuštěn ve 200 ml disulfidu uhličitého. Roztok chloridu kyseliny byl poté tenkým proudem přidán k intenzivně míchané suspenzi 240 g chloridu hlinitého v 1750 ml disulfidu uhličitého, která se nacházela v 5l baňce (v KAPALINĚ!!!). Došlo k oddělení komplexu a míchání bylo obtížné. Směs byla zahřívána pod zpětným chladičem a míchána po dobu jedné hodiny, aby byla reakce dokončena, poté byla velmi opatrně rozložena přidáním 500 g ledu, 250 ml kyseliny HCl a 500 ml vody. Během rozkladu bylo udržováno míchání a chlazení bylo ovlivňováno pravidelnou destilací disulfidu uhličitého ve vakuu a produkt byl extrahován 2 l benzenu. Extrakt byl důkladně promyt 500 ml 2N hydroxidu sodného ve třech dávkách a poté vodou. Byl vysušen nad síranem hořečnatým a poté odpařen na malý objem ve vakuu. Pomalé přidávání několika objemů etheru způsobilo krystalizaci žlutého ketonu (3) . Byl zfiltrován a promyt etherem; výtěžek 85,3 g (77 %), MP: 146-147 °C. Vzorek byl rekrystalizován pro analýzu z benzenetheru.
1-Benzoyl-4-bromo-5-keto-1,2,2a,3,4,5-hexahydrobenz-[cd]-indole (4)
1-Benzoyl-2,2a,3,4-tetrahydro-4-[methyl-(2-methyl-1,2-dioxolan-2-yl-methyl)-amino]-benz-[cd]-indol-5-(1H)-on (6)
Roztok 270 g (0,76 mol) 1-benzoyl-4-bromo-5-keto-1,2,2a,3,4,5-hexahydrobenz-[cd]-indolu(4) a 307 g (2.35 mol) methylaminoaceton ethylen ketalu (5) v 4500 ml suchého benzenu bylo refluxováno pod dusíkem po dobu 21 h v 10 l RBF se zpětným chladičem. Směs byla ochlazena a 151 g (93,5 %) hydrobromidu methylaminoaceton ethylene ketalu bylo zfiltrováno, MP: 158-159 °C.
Filtrát byl několikrát promyt ledovou vodou, poté byl extrahován 2,5 l studené zředěné kyseliny HCl obsahující 150 ml koncentrované kyseliny. Kyselé extrakty byly okamžitě přidány k přebytku ledově zředěného hydroxidu sodného. Produkt byl extrahován 1 l chloroformu a chloroformový roztok byl vysušen nad síranem hořečnatým, ošetřen uhlíkem a zkoncentrován ve vakuu. Zbytkový ketal-keton (6 ) byl vykrystalizován z acetonu; MP: a MP směsi: 135-136 °C, výtěžek 220 g (71 %).
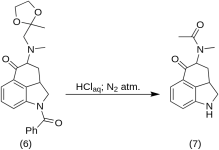
5-Keto-4-[N-methyl-N-acetonylamino]-1,2,2a,3,4,5-hexahydrobenz-[cd]-indol (7)
20 g 1-benzoyl-2,2a,3,4-tetrahydro-4-[methyl-(2-methyl-1,3-dioxolan-2-yl-methyl)-amino]-benz-[cd]-indol-5-(1H)-on (6 ) byl rozpuštěn ve směsi 250 ml koncentrované kyseliny HCl a 250 ml vody a roztok byl uchováván pod dusíkem při 37 °C v 3-5 l RBF po dobu pěti dnů. Směs byla ochlazena, ošetřena uhlíkem, zfiltrována a filtrát byl zkoncentrován ve vakuu na malý objem. Zbytek byl ošetřen přebytkem hydrogenuhličitanu sodného; produkt byl extrahován studeným chloroformem a rozpouštědlo bylo odstraněno ve vakuu při RT. Surový diketon (7 ) byl rozemlet na prášek, suspendován s asi 75 ml benzen-etheru v poměru 1:1 a zfiltrován; výtěžek 9,8 g (77 %), MP: 105-107 °C. Vzorek pro analýzu byl rekrystalizován z benzen-etheru nebo ethanolu; MP: 109-110 °C; monohydrochlorid byl získán ze zředěného ethanolu; MP: 200 °C dec.
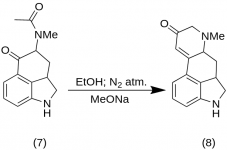
9-Keto-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolin (8)
25 g 5-Keto-4-[N-methyl-N-acetonyl]-amino-1,2,2a,3,4,5-hexahydrobenz-[cd]-indolu (7 ) bylo smícháno s 550 ml absolutního ethanolu. Směs byla míchána pod dusíkem a ochlazena na -15 °C v 2-5 l RBF. Poté byl přidán methoxid sodný, 16,9 g, a směs byla míchána při -10 °C až -12 °C po dobu deseti minut. Reakční směs byla ochlazena na -25 °C a produkt byl filtrován na 6,5palcové Buchnerově nálevce a promyt trochou studeného ethanolu a etheru. Při minimálním působení vzduchu (obsahuje methoxid sodný!) byl surový keton (8) okamžitě rozpuštěn s trochou ledové vody a znovu zfiltrován. Byl promyt ledovou vodou, ethanolem a etherem; výtěžek 16,2 g (69 %), MP: 145-147 °C. Analytický vzorek byl rekrystalizován ze zředěného ethanolu; MP: 155-157 °C; Dihydrochlorid byl připraven a rekrystalizován z vodného acetonu; MP: 270 °C dec.
4-Acetyl-9-keto-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolin (9)
9-Keto-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolin (8), 24 g, byl přidán do 80 ml studeného acetanhydridu. Směs byla udržována při 25 °C v 200 ml RBF po dobu asi 5 min, poté byla důkladně ochlazena a produkt (9 ) byl zfiltrován a promyt etherem; výtěžek 20,5 g (76 %), mp: 167-170 °C. Druhá kultura byla získána odpařením filtrátu; tím se celkový výtěžek zvýšil na 82 %. Vzorek byl rekrystalizován z aceton-ethanolu; MP: 169-170 °C; Hydrochlorid byl připraven v ethanolu a byl rekrystalizován z vodného ethanolu; MP: 250 °C dec.
9-Keto-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolin (8), 24 g, byl přidán do 80 ml studeného acetanhydridu. Směs byla udržována při 25 °C v 200 ml RBF po dobu asi 5 min, poté byla důkladně ochlazena a produkt (9 ) byl zfiltrován a promyt etherem; výtěžek 20,5 g (76 %), mp: 167-170 °C. Druhá kultura byla získána odpařením filtrátu; tím se celkový výtěžek zvýšil na 82 %. Vzorek byl rekrystalizován z aceton-ethanolu; MP: 169-170 °C; Hydrochlorid byl připraven v ethanolu a byl rekrystalizován z vodného ethanolu; MP: 250 °C dec.
4-Acetyl-9-hydroxy-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolin (10)
10 g 4-acetyl-9-keto-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroxindolo-[4,3-fg]-chinolinu (9 ) bylo přidáno do směsi 150 ml methanolu a 10 ml vody v 500 ml RBF. Byl přidán 1,5 g borohydridu sodného a reakce se nechala probíhat při RT na malý objem a byla přidána směs 15 ml konc. kyseliny HCl a 60 ml vody. Hydrochlorid (10 ), který se oddělil při ochlazování, byl přefiltrován a promyt methanolem, 9,0 g (79 %). Vzorek byl rekrystalizován ze zředěného ethanolu; MP: 245-246 °C dec.
4-acetyl-9-chloro-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolin hydrochlorid (11)
4-acetyl-9-hydroxy-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolin hydrochlorid (10), 3. látka, 3. látka.1 g byl rozpuštěn v 75 ml kapalného oxidu siřičitého ve skleněné vložce v ocelovém autoklávu o objemu 500 ml. Byl přidán thionylchlorid, 1,2 ml, nádoba byla uzavřena a udržována při 25 °C po dobu 6 h. Autokláv byl odvzdušněn a reakční směs byla odstraněna. Oxid siřičitý se nechal odpařit, zatímco objem roztoku se udržoval konstantní pomalým přidáváním suchého etheru. Amorfní chlorhydrochlorid (11 ) byl zfiltrován, promyt etherem a vysušen ve vakuu, MP: 130-135 °C dec. Výtěžek 3,5 g. Použití9-beta-epimerního alkoholu v této reakci poskytlo stejný chlorid ve srovnatelném výtěžku.
4-Acetyl-9-kyano-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolin (12)
Suchý práškový kyanid sodný, 40 g, byl přidán do 300 ml ledově studeného kapalného kyanovodíku. Směs byla promíchána a ochlazena v ledu a bylo přidáno 7,5 g surového amorfního 4-acetyl-9-chlor-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo[4,3f/g]-chinolin-hydrochloridu ( 11 ) uvedeného výše. Míchání pokračovalo v 500 ml RBF po dobu 30 min, poté byl kyanovodík rychle vydestilován za sníženého tlaku při teplotě asi 10 °C. Zbytek byl smíchán s chloroformem a ledovou vodou a vzniklá směs byla zfiltrována. Organická vrstva byla oddělena a vodná fáze byla dvakrát extrahována chloroformem. Spojené extrakty byly vysušeny nad síranem hořečnatým, odbarveny a rozpouštědlo bylo vydestilováno ve vakuu. Produkt (12) byl vykrystalizován z ethylacetátu; výtěžek 3,3 g (54 % všech látek na bázi alkoholhydrochloridu), m.p. 172-174 °C. Rekrystalizací ze stejného rozpouštědla se m.p. zvýšil na 181-182 °C.
Suchý práškový kyanid sodný, 40 g, byl přidán do 300 ml ledově studeného kapalného kyanovodíku. Směs byla promíchána a ochlazena v ledu a bylo přidáno 7,5 g surového amorfního 4-acetyl-9-chlor-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo[4,3f/g]-chinolin-hydrochloridu ( 11 ) uvedeného výše. Míchání pokračovalo v 500 ml RBF po dobu 30 min, poté byl kyanovodík rychle vydestilován za sníženého tlaku při teplotě asi 10 °C. Zbytek byl smíchán s chloroformem a ledovou vodou a vzniklá směs byla zfiltrována. Organická vrstva byla oddělena a vodná fáze byla dvakrát extrahována chloroformem. Spojené extrakty byly vysušeny nad síranem hořečnatým, odbarveny a rozpouštědlo bylo vydestilováno ve vakuu. Produkt (12) byl vykrystalizován z ethylacetátu; výtěžek 3,3 g (54 % všech látek na bázi alkoholhydrochloridu), m.p. 172-174 °C. Rekrystalizací ze stejného rozpouštědla se m.p. zvýšil na 181-182 °C.
9-karbomethoxy-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolin (13)
Právě uvedený produkt (12 ), 1,0 g, byl smíchán s 15 ml methanolu a 0,25 ml vody. Směs byla ochlazena a pomalu byly přidány 2 ml koncentrované kyseliny sírové. Roztok byl uzavřen ve skleněné trubici pod dusíkem a zahříván při 100 °C po dobu 23 až 24 h ve 100 ml RBF se zpětným chladičem. Směs byla ošetřena dekolorizovaným uhlíkem a poté zkoncentrována ve vakuu na přibližně 10 ml. Byla přelita na směs chloroformu (30 ml), ledu a 10 g hydrogenuhličitanu sodného. Chloroformová vrstva byla oddělena a vodná fáze byla extrahována 3 x 10 ml dávkami chloroformu. Spojené extrakty byly vysušeny nad síranem hořečnatým, odpařeny do sucha a produkt (13) byl vykrystalizován z benzenu; výtěžek 0,51 g (53 %), MP: 159-160 °C. Byl rekrystalizován z ethylacetátu; MP: 160-161 °C.
Právě uvedený produkt (12 ), 1,0 g, byl smíchán s 15 ml methanolu a 0,25 ml vody. Směs byla ochlazena a pomalu byly přidány 2 ml koncentrované kyseliny sírové. Roztok byl uzavřen ve skleněné trubici pod dusíkem a zahříván při 100 °C po dobu 23 až 24 h ve 100 ml RBF se zpětným chladičem. Směs byla ošetřena dekolorizovaným uhlíkem a poté zkoncentrována ve vakuu na přibližně 10 ml. Byla přelita na směs chloroformu (30 ml), ledu a 10 g hydrogenuhličitanu sodného. Chloroformová vrstva byla oddělena a vodná fáze byla extrahována 3 x 10 ml dávkami chloroformu. Spojené extrakty byly vysušeny nad síranem hořečnatým, odpařeny do sucha a produkt (13) byl vykrystalizován z benzenu; výtěžek 0,51 g (53 %), MP: 159-160 °C. Byl rekrystalizován z ethylacetátu; MP: 160-161 °C.
Syntetická kyselina dl-Lysergová (14)
Směs 9-karbomethoxy-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolinu (13), 3,9 g, a 78 ml 1,5% roztoku hydroxidu draselného byla refluxována 30 min pod dusíkem. Byl přidán hydratovaný arsenan sodný, 8,5 g, a Raneyho nikl (16 g, mokrý), předem deaktivovaný varem v xylenové suspenzi, a směs byla zahřívána pod zpětným chladičem a míchána v dusíkové atmosféře po dobu 20 hodin v 200 ml RBF se zpětným chladičem. Roztok byl ošetřen uhlíkem a neutralizací na pH 5,6 byla vysrážena surová kyselina lysergová (14 ). Byla zfiltrována a promyta vodou; výtěžek 1,04 g, MP: 240-242 °C dec. Byla získána také druhá kultura, 0,16 g, MP: 233-235 °C dec.; celkový výtěžek 30 %. Kyselinu bylo možné přečistit rozpuštěním ve zředěném hydroxidu amonném, ošetřením odbarvovacím uhlíkem a opětovným vysrážením oxidem uhličitým, MP: 242-243 °C dec; směs s kyselinou dl-lysergovou vyrobenou z přírodní kyseliny d-lysergové měla rovněž 242-243 °C dec. Bezvodá kyselina byla získána několikahodinovým sušením ve vakuu při 150 °C.
Směs 9-karbomethoxy-7-methyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-chinolinu (13), 3,9 g, a 78 ml 1,5% roztoku hydroxidu draselného byla refluxována 30 min pod dusíkem. Byl přidán hydratovaný arsenan sodný, 8,5 g, a Raneyho nikl (16 g, mokrý), předem deaktivovaný varem v xylenové suspenzi, a směs byla zahřívána pod zpětným chladičem a míchána v dusíkové atmosféře po dobu 20 hodin v 200 ml RBF se zpětným chladičem. Roztok byl ošetřen uhlíkem a neutralizací na pH 5,6 byla vysrážena surová kyselina lysergová (14 ). Byla zfiltrována a promyta vodou; výtěžek 1,04 g, MP: 240-242 °C dec. Byla získána také druhá kultura, 0,16 g, MP: 233-235 °C dec.; celkový výtěžek 30 %. Kyselinu bylo možné přečistit rozpuštěním ve zředěném hydroxidu amonném, ošetřením odbarvovacím uhlíkem a opětovným vysrážením oxidem uhličitým, MP: 242-243 °C dec; směs s kyselinou dl-lysergovou vyrobenou z přírodní kyseliny d-lysergové měla rovněž 242-243 °C dec. Bezvodá kyselina byla získána několikahodinovým sušením ve vakuu při 150 °C.
Attachments
Last edited: